Kimyasal Türler, Güçlü Etkileşimler Kimya Ayt
GÜÇLÜ ETKİLEŞİMLER
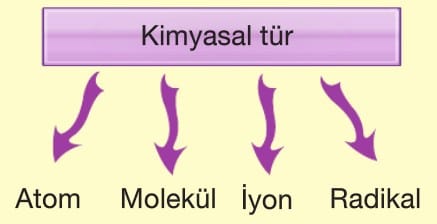
Kimyasal Türler
Maddeler tanecikli yapılardan meydana gelmişlerdir. Maddelerin özelliklerini taşıyan en küçük yapı birimine kimyasal tür denir.
Atom: Elementlerin yapısını oluşturan ve bütün özelliklerini taşıyan en küçük yapı birimine atom denir. Örneğin, altın metali (Au), altın atomlarından meydana gelmiştir.
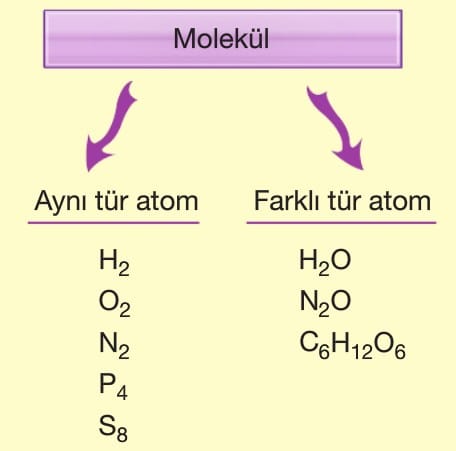
Molekül: Birden fazla ametal atomunun kimyasal bağlarla oluşturdukları saf maddelere molekül denir.
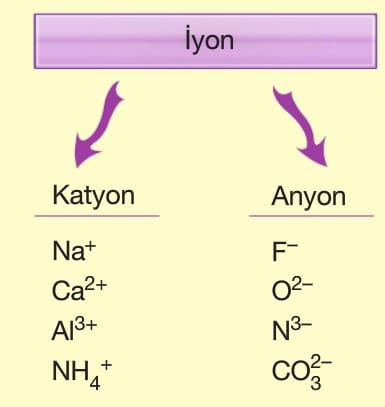
İyon: Elektron sayısı proton sayısına eşit olmayan taneciklere iyon denir.
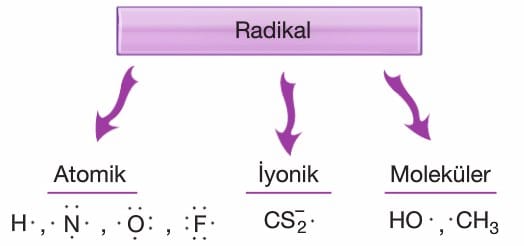
Radikal: Dubietini ya da oktetini tamamlayamayan bu nedenle tepkimeye istekli kimyasal türlere radikal denir.
- Radikaller yüksek enerjili ve kararsızdırlar.
- Atomik, iyonik ve moleküler yapıda bulunabilirler.
Kimyasal Bağların Oluşumu
Kimyasal türde bulunan yüklü tanecikler kimyasal türlerdeki bağın oluşumunda etkin rol oynarlar. Bu yüklü tanecikler aynı yüklü ise birbirini iter, farklı yüklü iseler birbirini çekerler. Çekme kuvvetleri ile itme kuvvetlerinin güçleri birbirine yakın ise zayıf etkileşim, çekme kuvvetleri itme kuvvetlerinden çok büyük ise kuvvetli etkileşim oluşur.
Güçlü etkileşimler sonucunda kimyasal bağ oluşur.
Zayıf etkileşimler sonucunda fiziksel bağ oluşur.
Bağ Enerjileri
Atomları bir arada tutan bağları koparmak için gereken enerjiye bağ enerjisi denir.
- Bağın kırılması endotermik (ısı alan) tir.
- Bağın oluşması ekzotermik (ısı veren) tir.
- Bir tepkimedeki enerji değişimi 40 kJ/mol değerinden büyükse kimyasal bağ oluşmuş ya da kırılmış olabilir.
- Tepkimelerde kimyasal bağın oluşabilmesi ya da koparılabilmesi için kimyasal türlerin değişmesi gerekir.
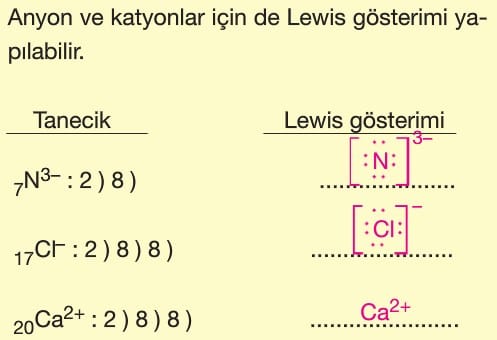
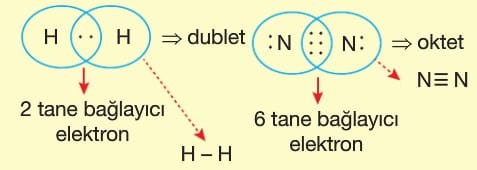
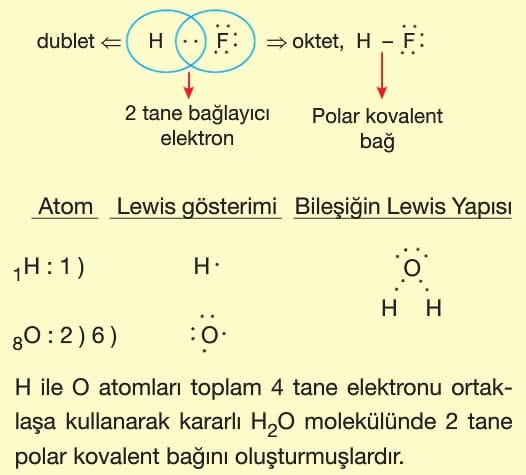
Lewis Yapısı
Son katmanındaki toplam elektron sayısının taneciğin sembolü çevresinde nokta ile gösterilmesine Lewis gösterimi denir.
Değerlik elektron sayısı sembolün çevresinde her yöne önce birer tane konulur.
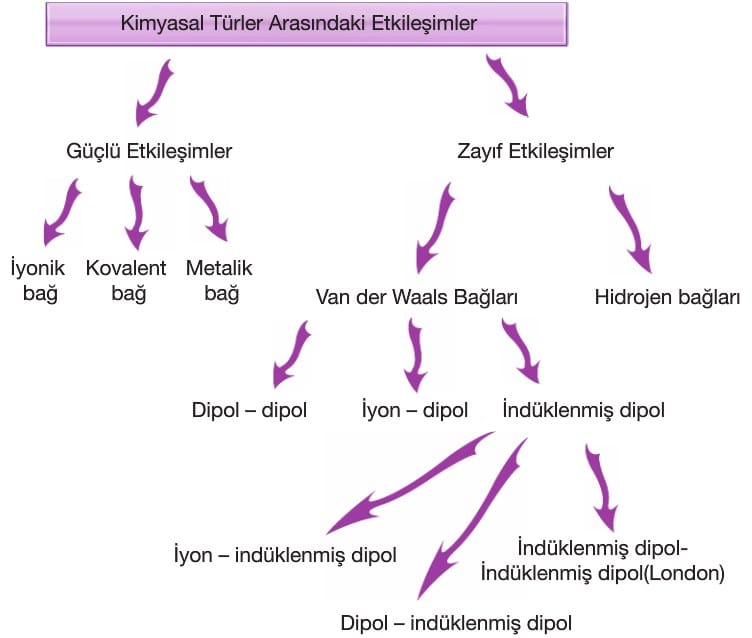
Güçlü Etkileşimler
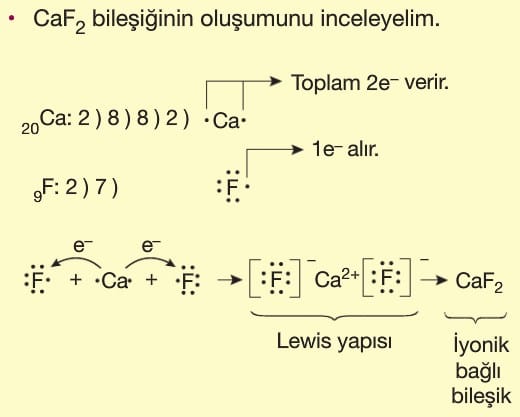
İyonik Bağ: Metal atomu ile ametal atomu arasında elektron alış-verişi ile gerçekleşir. Bunun sonucunda metal atomu katyon, ametal atomu anyona dönüşürken aralarında bir elektrostatik çekim kuvveti oluşur. Bu elektrostatik çekim kuvvetine iyonik bağ denir.
İyonik bağlı bileşiklere iyonik bileşik denir.
İyonik Bağların Sağlamlığı
- İyonik bağlı bileşiklerde bağın sağlamlığı bileşiği oluşturan taneciklerin özelliğine bağlıdır.
- Taneciklerin iyon yükü arttıkça elektrostatik çekim kuvveti artar.
- Tanecikler arasındaki uzaklık arttıkça elektrostatik çekim kuvveti azalır.
- Taneciklerin iyon yarıçapı arttıkça aralarındaki uzaklık artar.
- İyonik bağın sağlamlığı arttıkça bileşiğin erime noktası artar.
İyonik Bağlı Bileşikleri Özellikleri
- İyonik bağlı bileşiklerin erime noktaları tanecikler arasındaki güçlü etkileşimden dolayı yüksektir.
- İyonik bağlı bileşiklerin fiziksel yapısı katı hâlde sert, kırılgan ve kristal yapılıdırlar.
- İyonik bağlı bileşiklerin katı hâli elektriği iletmezken sıvı ve çözeltileri elektriği iletir.
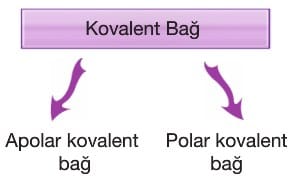
Kovalent Bağ
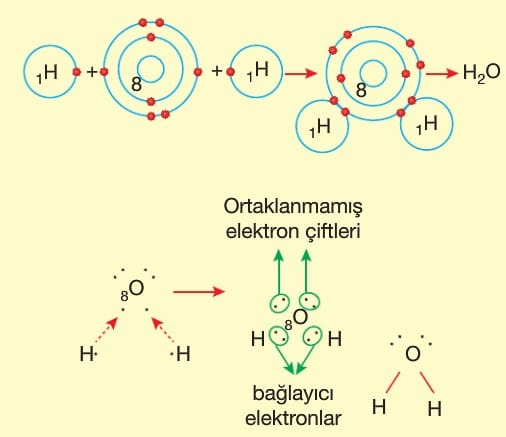
Ametal atomlarının elektron ortaklaşması ile oluşturduğu bağa kovalent bağ denir.
Kovalent bağlı bileşiklere kovalent bileşik denir.
Apolar Kovalent Bağ: Aynı tür ametal atomlarının elektron ortaklaşması ile oluşturduğu bağa apolar kovalent bağ denir.
Polar Kovalent Bağ: Farklı tür ametal atomlarının elektron ortaklaşması ile oluşturduğu bağa polar kovalent bağ denir.
Örneğin; NaCl bileşiğindeki atomların elektronegatiflik farkı 2,1 iken NaF bileşiğindeki elektronegatiflik farkı 3,1 dir. Bu nedenle NaF bileşiğindeki bağların iyonik karakteri daha fazladır.
Metalik Bağ
Metal atomları arasında meydana gelen güçlü etkileşimlere metalik bağ denir. Metalik bağın oluşumunda metalin serbest hareket eden değerlik elektronlarından kaynaklı elektron denizi etkilidir.
Periyotlarda atom numarasının arttığı yönde metalik bağ kuvveti artarken gruplarda ise atom numarasının arttığı yönde metalik bağ kuvveti azalır.
Metalik bağ sayesinde metallerin kazandığı özellikler; parlaklık, elektrik iletkenliği ve şekil alabilmedir.