İyonik Bileşiklerin Adlandırılması ve Yazılması 9. Sınıf Kimya Konu Anlatımı
9. Sınıf İyonik Bileşiklerin Adlandırılması Testleri
9. Sınıf İyonik Bileşiklerin Adlandırılması ve Yazılması Ders notu
İyonik bileşikler, bir metal ile bir ametal atomunun elektron alışverişi sonucu oluşur. Metal atomu elektron vererek pozitif yüklü iyon (katyon), ametal atomu ise elektron alarak negatif yüklü iyon (anyon) haline gelir. Bu zıt yüklü iyonlar arasında elektrostatik çekim kuvveti oluşur ve böylece iyonik bileşikler meydana gelir. İyonik bileşiklerin doğru bir şekilde adlandırılması ve yazılması, kimyada önemli bir yer tutar ve bileşiğin kimyasal yapısının doğru bir şekilde ifade edilmesine olanak tanır.
İyonik Bağlı Bileşiklerin Adlandırılması
İyonik bağlı bileşikler, metal ile ametal arasında elektron alışverişiyle oluşurken kovalent bağ, ametal atomları arasında elektronların ortaklaşa kullanılmasıyla oluşur. İyonik bileşikleri adlandırabilmek için çok kullanılan elementler ve değerliklerinin bilinmesi gerekir.
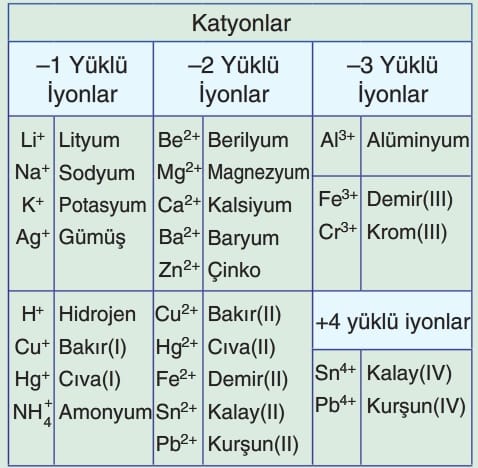
Değişken değerlik alan elementlerin değerliği parantez içine Romen rakamıyla yazılır.
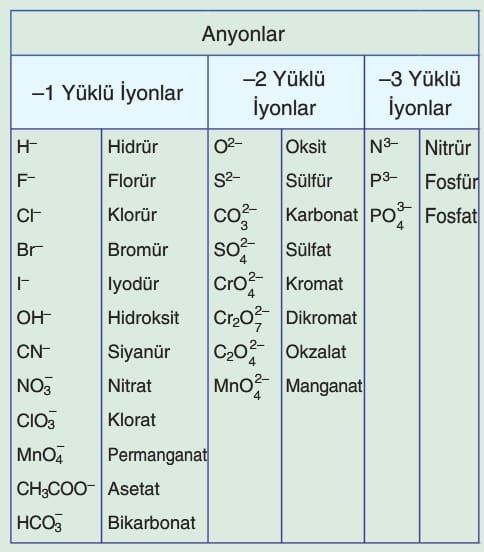
Flor sadece —1 yüklü olabilir. Diğer ametaller bileşiklerinde (—) değerlik dışında (+) değerlik de alabilir. Örneğin CI, —1, +1, +3, +5, +7
yükseltgenme basamaklarına sahip olabilir.
Çözümlü Örnek Sorular
Soru 1:
Aşağıdaki iyonik bileşiklerden hangisinin adı doğrudur?
A) NaCl → Sodyum florür
B) CaO → Kalsiyum oksit
C) K₂S → Potasyum nitrit
D) MgF₂ → Magnezyum oksit
Çözüm:
NaCl, sodyum klorür, CaO kalsiyum oksit, K₂S potasyum sülfür, MgF₂ ise magnezyum florür olarak adlandırılır.
Sonuç: B) CaO → Kalsiyum oksit
Soru 2:
MgCl₂ bileşiği nasıl adlandırılır?
A) Magnezyum klorür
B) Magnezyum diklorit
C) Magnezyum triklorit
D) Magnezyum sülfür
Çözüm:
MgCl₂ bileşiği, bir magnezyum atomu ile iki klor atomundan oluşur ve magnezyum klorür olarak adlandırılır.
Sonuç: A) Magnezyum klorür
Soru 3:
Al₂O₃ bileşiğinin adı nedir?
A) Alüminyum oksit
B) Alüminyum hidroksit
C) Alüminyum dioksit
D) Alüminyum sülfür
Çözüm:
Al₂O₃, iki alüminyum atomu ve üç oksijen atomundan oluşan bir bileşiktir. Bu bileşik alüminyum oksit olarak adlandırılır.
Sonuç: A) Alüminyum oksit
Soru 4:
Na₂SO₄ bileşiği hangi isimle adlandırılır?
A) Sodyum sülfat
B) Sodyum sülfür
C) Sodyum nitrür
D) Sodyum klorat
Çözüm:
Na₂SO₄ bileşiği, iki sodyum iyonu ve bir sülfat iyonundan oluşur ve sodyum sülfat olarak adlandırılır.
Sonuç: A) Sodyum sülfat
Soru 5:
Ba(NO₃)₂ bileşiğinin adı nedir?
A) Baryum nitrit
B) Baryum nitrat
C) Baryum sülfat
D) Baryum klorür
Çözüm:
Ba(NO₃)₂ bileşiği, bir baryum iyonu ile iki nitrat iyonundan oluşur ve baryum nitrat olarak adlandırılır.
Sonuç: B) Baryum nitrat
Özet:
İyonik Bileşiklerin Adlandırılması
İyonik bileşiklerin adlandırılmasında temel kurallar şunlardır:
- Katyonun Adı: İlk önce pozitif yüklü iyon olan katyonun adı yazılır. Bu, genellikle bir metal elementin adıdır. Örneğin, Na⁺ için “sodyum” ve Ca²⁺ için “kalsiyum” kullanılır.
- Anyonun Adı: Katyonun ardından, negatif yüklü iyon olan anyonun adı gelir. Ametaller genellikle “-ür,” “-ürid” gibi ekler alır. Örneğin, Cl⁻ için “klorür” ve O²⁻ için “oksit” kullanılır.
- Birden Fazla Yüklü Katyonlar: Eğer katyon birden fazla yüke sahipse, katyonun yükü parantez içinde Romen rakamlarıyla belirtilir. Örneğin, Fe²⁺ (demir II) ve Fe³⁺ (demir III).
Örnekler:
- NaCl: Sodyum klorür
- CaO: Kalsiyum oksit
- FeCl₂: Demir (II) klorür
- FeCl₃: Demir (III) klorür
İyonik Bileşiklerin Yazılması
İyonik bileşiklerin kimyasal formüllerini yazarken, iyonların yük dengesi dikkate alınır. Katyon ve anyonların yükleri birbirini nötrleyecek şekilde düzenlenir.
- Adım 1: Katyonun ve anyonun yüklerini belirleyin.
- Adım 2: Yükleri dengelemek için gerekli sayıda iyon yazın.
- Adım 3: Yükleri dengeleyin ve formülü yazın.
Örnekler:
- Sodyum klorür (Na⁺ ve Cl⁻): NaCl
- Magnezyum oksit (Mg²⁺ ve O²⁻): MgO
- Kalsiyum fosfat (Ca²⁺ ve PO₄³⁻): Ca₃(PO₄)₂
Ahh bide anlasammmm😑😑
arkadaslar yarin kimya sinavim var bu ne cok zor ya
Çok teşekkürler
iyi
ben bunu ezberlersem kıyamet kopar o yüzden öyle bir şey yapmayıp kopya yazıyım
guzelmis
iyi de ezberle ezberle nereye kadar ?
aslında ezberlersek aklımızda kalır diğer türlü yaparsak hiç unutmayız ama ezberlemek daha kolay
Kankam ben anlamasamda olur be bu konuları biz nasıl akılda tutacaz
Nasipte varsa anlariz
Benim beynimin çalışmamasına rağmen beğendim muq
Gerçekten beğendim 👑👑👑
Anlaşılır ve güzel
Efsane
güzel sayfa
Bayildim bilgiler süpercok aciklayıcı olmuş👍👌