Periyodik Sistem ve Özellikleri Kimya Tyt
PERİYODİK SİSTEM ve ÖZELLİKLERİ
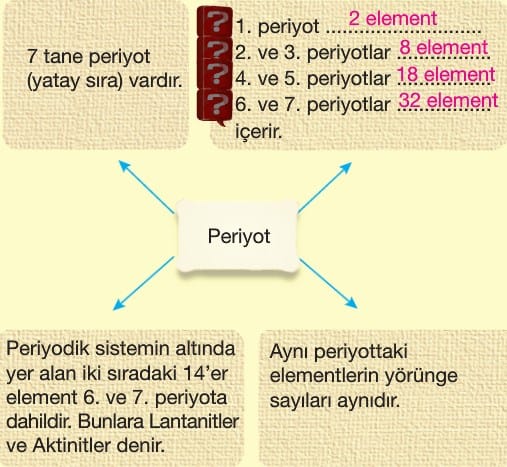
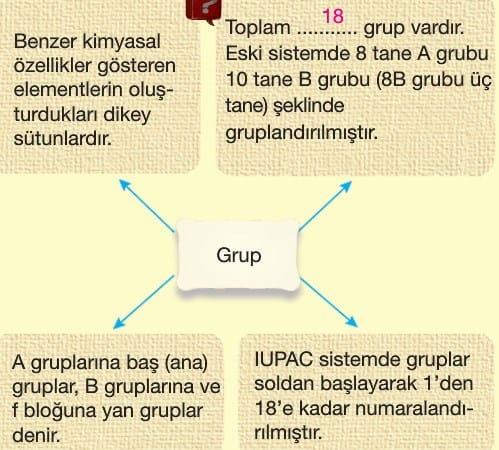
Periyodik Sistem
Periyodik Sistemin Tarihçesi:
19. yüzyıla gelindiğinde 45 tane element bulunmuştu. Tarihsel süreç içerisinde elementlerin fiziksel ve kimyasal benzerliklerine göre sınıflandırılması düşüncesi ortaya çıkmıştır.
Triadlar (Üçlüler) Kuralı:
J.W. Döbereiner (1780—1849) elementleri benzer özelliklerine göre üçerli gruplar hâlinde gruplandırdı. Buna göre Li, Na, K bir seriyi; Ca, Sr, Ba başka bir seriyi ve CI, Br, I diğer bir seriyi oluşturur. Bu seride örnek olarak Na’nın fiziksel ve kimyasal özelliklerinin Li ve K’ya çok benzediğini, Na’nın atom kütlesinin Li ve K’nin atom kütleleri toplamının yarısı kadar olduğunu fark etti.
Bu şekilde elementleri üçlü gruplar hâlinde sınıflandırarak, buna üçlüler anlamına gelen Triadlar kuralı ismini verdi.
Oktavlar Kuralı:
John Newlands 1864 yılında bilinen elementleri atom ağırlığının artışına göre ardışık bir sıralama sonucu ile müzikteki notalara benzer şekilde (dore-mi-fa-sol-la-si-do…) tam uyumlu olduğunu görerek buna Oktavlar kuralı adını verdi.
Ayrıca De Chancourtois elementleri atom kütlelerine göre bir silindir üzerindeki 16 sütuna yerleştirerek basit bir periyodik sistem oluşturdu.
İlk bilimsel anlamda periyodik sistemin temelini oluşturan bilim insanları Dimitri Mendeleyev (1869) ve J.Lothar Meyer (1870) olmuştur. İki bilim insanı ayrı ayrı yapmış oldukları çalışmalar ile elementleri atom ağırlıklarına göre düzenlemişlerdir. D. Mendeleyev, her bir satıra artan atom kütlelerine göre elementleri yerleştirmiş, periyodik olarak alt alta gelen elementlerin benzer özelliklere sahip olduğunu görmüştür. Bu sistemiyle benzer elementleri grup adı verilen dikey sütunlara yerleştirmiş oldu.
Modern Periyodik Sistem
Mendeleyev, elementlerin periyodik özeliklerini atom ağırlıklarına göre sıraladığında benzer özelliklere sahip elementleri alt alta getirmeye dikkat etmişti. Ancak daha sonraki süreçte yeni elementlerin keşfedilmesiyle bu durum ciddi sıkıntılar oluşturmuştur.
Daha sonra 1913 yılında Henry Moseley X ışınları ile yapmış olduğu deneyde elementlerin atom ağırlıklarına göre değil, atom numaralarına (proton sayılarına) göre yeniden düzenlenmesi gerektiğini ortaya koydu. Moseley’in tanımladığı periyodik sistem bugün kullanılan periyodik tablonun temelini oluşturur.
Periyodik tabloda her bir yatay sıraya periyot her bir dikey sütuna grup denir.
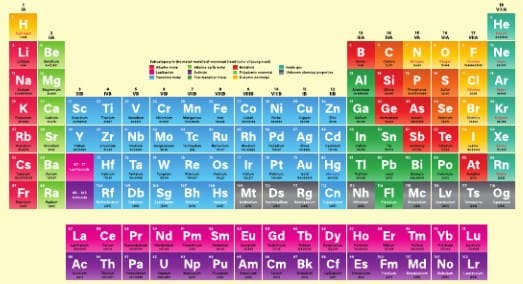
Periyodik Tablodaki Elementler
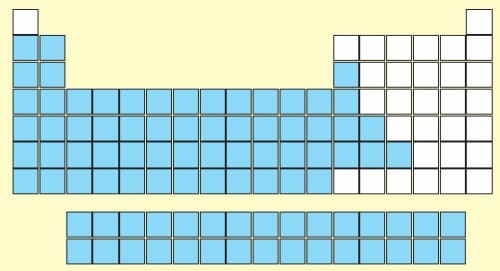
1 . METALLER
- Periyodik tabloda 1, 2, 3A ve B gruplarında bulunan elementlerdir. Katı ve sıvı halde elektrik akımını iletirler.
- Civa (Hg) dışında oda koşullarında katı haldedirler
- Erime noktaları yüksektir.
- Yeni kesilmiş yüzeyleri parlaktır.
- İşlenebilir, tel ve levha haline getirilebilirler.
- Daima elektron verirler.
- Birbirleri ile bileşik oluşturmaz alaşım denilen homojen karışımları oluştururlar.
- Ametallerle iyonik yapılı bileşikler oluştururlar.
- Atomik yapılıdırlar; kendi kendileriyle molekül oluşturamazlar.
- Oksijenli bileşikleri genellikle bazik özelliktedir.
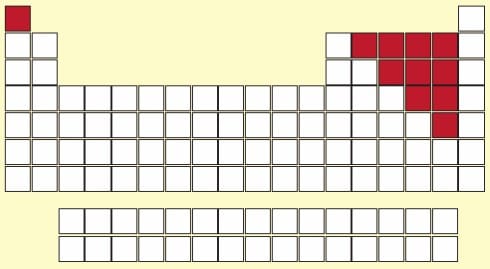
2. AMETALLER
- Periyodik tablonun sağ tarafında 4,5,6,7A gruplarında bulunurlar
- Toplam 11 tanedir; Hidrojen (H), Oksijen (O), Fosfor (P), Karbon (C), Azot (N), Kükürt (S), Selenyum (Se), Flor (F), Klor (Cl), Brom (Br), İyot (I)
- Karbonun allotropu olan grafit hariç elektriği iletmezler.
- Oda koşullarında katı, sıvı ve gaz halde bulunan ametaller vardır.
- Erime — kaynama noktaları iyonik bileşiklere göre düşüktür.
- Yüzeyleri mat veya saydamdır.
- Kırılgandırlar, işlenemezler.
- Elektron alma istekleri yüksektir ancak bileşiklerinde (flor hariç) elektron verebilirler de.
- Birbirleri ile kovalent bağlı bileşik oluştururlar.
- Metallerle iyonik yapılı bileşikler oluştururlar.
- Moleküllü yapıya sahiplerdir. (O2, S4, P8 gibi)
- Oksijenli bileşikleri genellikle asidiktir.
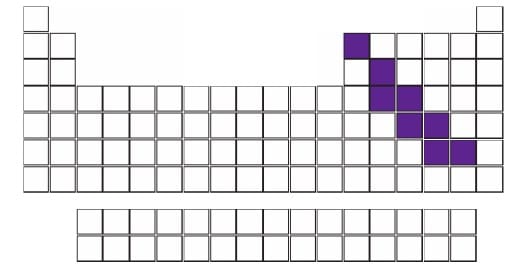
3. YARI METALLER
- Periyodik cetvelde metallerle ametaller arasındaki sınırda bulunan elementlerdir.
- Oda koşullarında katı haldelerdir.
- Toplam 8 tane elementten oluşur; Bor (B), Silisyum (Si) Germanyum (Ge) Arsenik (As) Antimon (Sb) Tellür (Te) Polonyum (Po) ve Astatin (At)
- Fiziksel açıdan metallere kimyasal açıdan ametallere benzerler.
- Yarı iletken özellik gösterirler
- İşlenebilirler.
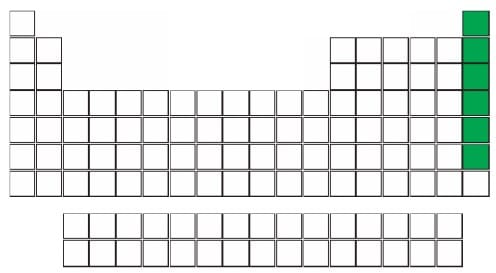
4. SOYGAZLAR
- Periyodik tablonun en sağında bulunan 6 tane elementtir; Helyum (He), Neon (Ne), Argon (Ar), Kripton (Kr), Ksenon (Xe), Radon (Rn)
- Oda koşullarında gaz haldelerdir.
- Elektron alma veya verme yatkınlıkları yoktur.
- Kimyasal açıdan pasiflerdir.
- Yanmazlar.
- Bileşik oluşturma istekleri yoktur.
- Oda koşullarında atomik yapılılardır.
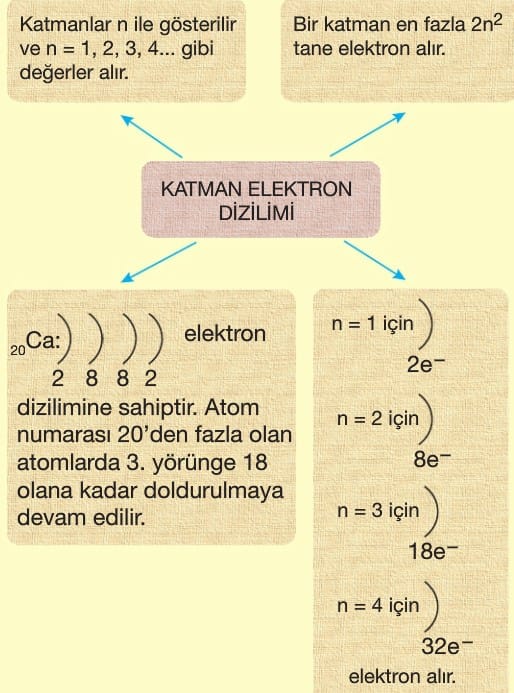
Katman Elektron Dizilimi
Bir atomdaki elektronlar, çekirdek çevresinde bulunan katmanlara göre dizilirler. Bu dizilim elementlerin kimyasal olaylarda elektron alıp-verme veya ortaklaşa kullanma gibi davranışlarını belirler.
Periyodik Sistemde Yer Bulma
Periyodik sistemde bir elementin periyodunu (sırasını) enerji katmanı sayısı belirler. Elementin en dış katmanında yer alan elektronlara “değerlik” elektronları denir. Değerlik elektronu elementin periyodik sistemdeki grubunu belirler. Değerlik elektron sayıları elementlerin kimyasal özelliklerini açıklamada önemli bir ölçüdür.