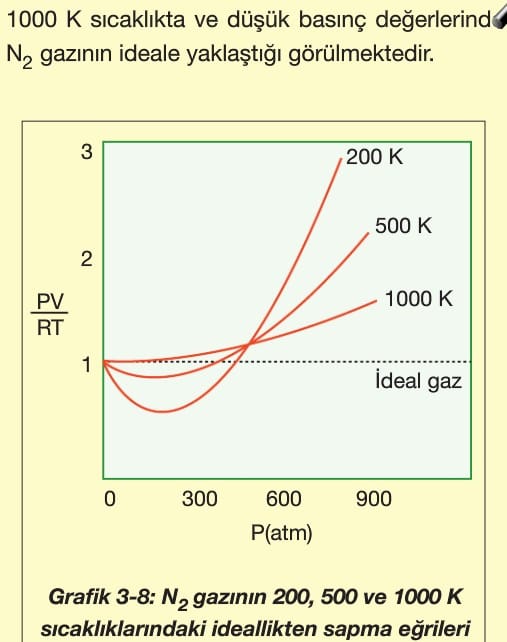
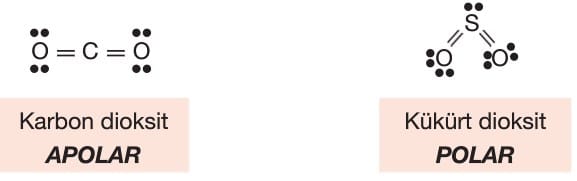Gerçek Gazlar Kimya Ayt
GERÇEK GAZLAR
İdeal Gazdan Sapmalar
Kinetik Teoriye Göre ideal bir gazda,
1) Moleküller arası çekme ve itme kuvvetleri yoktur.
2) Moleküllerin kendi hacimleri kabın hacmine oranla ihmal edilebilecek kadar küçüktür.
Gazların ideallikten sapmasına neden olan faktörler:
1) Basınç
2) Sıcaklık
3) Gazın türü
1. Yüksek Basınç:
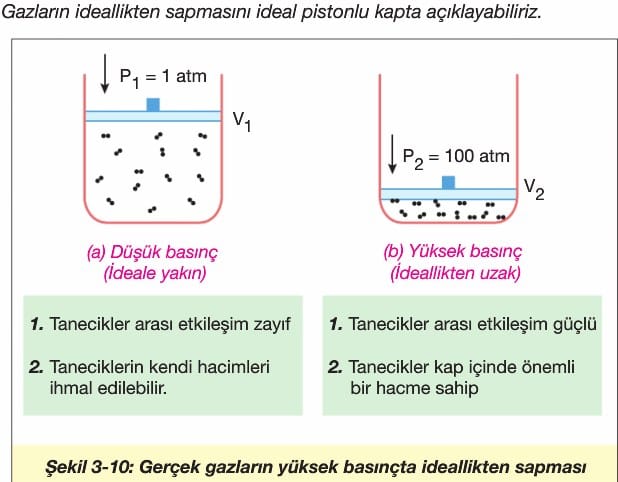
Kinetik teoriden hatırlayacağımız gibi gerçekte ideal gaz yoktur. Çünkü, gerçekte gaz tanecikleri arasında çok küçük de olsa çekme kuvvetleri vardır ancak düşük basınçta etkisi azdır. Eğer bir gaz çok yüksek bir basınca kadar (200-300 atm gibi) sıkıştırılırsa kabın hacmi 0 kadar azalır ki gaz tanecikleri arası etkileşimlerin çekim kuvveti ihmal edilemeyecek kadar artar. Gazların yüksek basınçta sıvılaştırılabilmesi, bu şekilde gaz tanecikleri arasındaki etkileşimlerin yüksek basınçta (düşük hacim) etkisinin artmasıyla gerçekleşir. (Şekil 3-10)
ideal gaz ile ilgili ikinci kabülümüz, gaz taneciklerinin kendi hacminin bulunduğu kabın hacmine oranla ihmal edilebilecek kadar küçük olmasıdır. Yüksek basınç altında küçük hacme sıkıştırılan gazlarda bu özellik de geçerliliğini büyük oranda kaybeder. Çünkü, kabın hacmi yüksek basınçta o kadar azalır ki gaz taneciklerinin kap içerisinde kapladığı hacim oransal olarak artar. Dolayısıyla ihmal edilemez.
2. Düşük Sıcaklık:
Gerçek gazlar yüksek sıcaklıkta ideale yakındırlar. Çünkü, düşük sıcaklıkta ortalama kinetik enerji azalacağından gaz taneciklerinin hareketi yavaşlar, tanecikler birbirine yaklaşır ve tanecikler arası etkileşimler artar. Böylelikle, yüksek basınç etkisinde Şekil 3-10 (b)’dekine benzer bir etki görülür.
(a) kabındaki gazın basıncını iki katına çıkarmak için hacmini yarıya indirebiliriz. Yani, Boyle Yasası geçerlidir. Ancak, aynı işlemi (b) kabında yaptığımızda gaz taneciklerinin hacmi ihmal edilemeyecek oranda olduğundan kabın hacmi yarıya inmez. Yarısından daha fazla olur. Dolayısıyla (a) kabındaki gerçek gaz (b) kabındakine göre ideale daha yakındır.
Bu nedenle, çok düşük sıcaklıklarda Charles Yasası (V — T ilişkisi) tamamen geçerli değildir. Charles Yasasına göre mutlak sıcaklığı yarıya indirilen gazların hacmi yarıya iner. Ancak, çok düşük sıcaklıklarda aynen yüksek basınçta olduğu gibi gaz tanecikleri zaten oldukça sıkıştırılmış olduklarından, kapladıkları hacim yarıya inecek kadar sıkıştırılamazlar.
3. Gazın Cinsi:
Gazın cinsi iki açıdan önemlidir:
1) Moleküllerinin büyüklüğü
2) Moleküller arası etkileşimin kuvveti
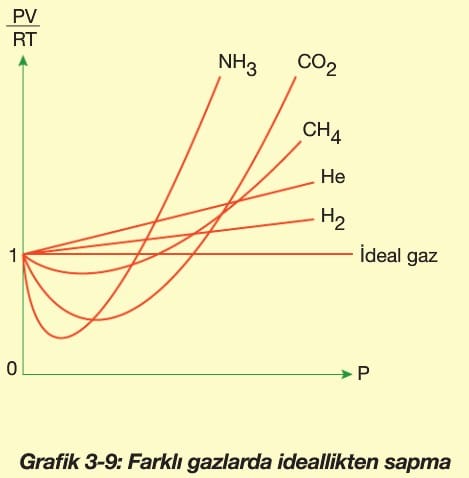
Küçük moleküllü gazlar ideale daha yakındırlar. Çünkü, küçük tanecikli gazlar için, kinetik teoride kabul ettiğimiz gaz taneciklerinin kendi hacimleri bulunduğu kabın hacmine oranla ihmal edilebilir varsayımı daha geçerli olur. Bu nedenle, H2 ve He gibi gazlar ideale en yakın gazlardandır.
Moleküller arası etkileşim de gazların idealliğini etkiler. Yine kinetik teoriden hatırlayacağımız üzere gaz tanecikleri arası çekim kuvvetlerini yok varsayarız. Bu varsayımımız molekülleri arasında sadece zayıf çekim kuvvetleri (indüklenmiş dipol) olan apolar moleküllerde daha doğru olur. Molekülleri arasında dipol—dipol gibi daha güçlü etkileşimler oluşabilen polar moleküllü gazlar ideallikten daha uzaktır. Bu nedenle, apolar CO2 gazı ideal gaza polar SO2‘den daha yakındır.
Gerçek Gazların İdeallikten Sapmalarının Sonuçları
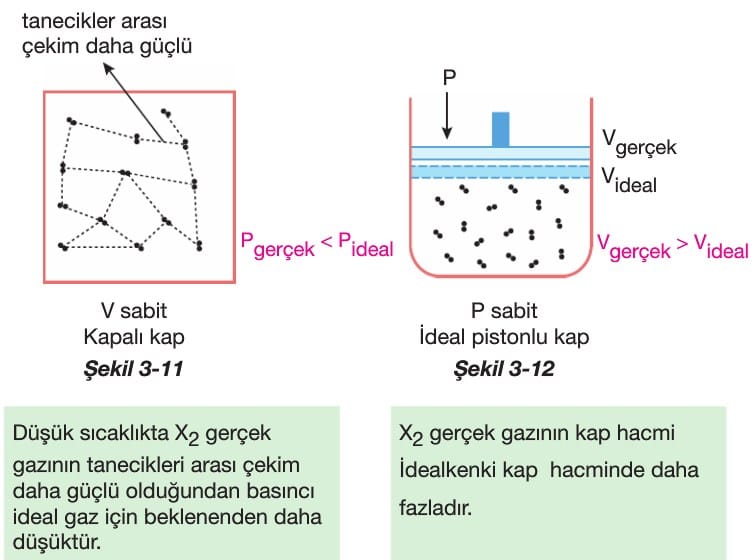
Gerçek gazlar düşük sıcaklık ve yüksek basınçta ideallikten saparlar. Düşük sıcaklıkta, sabit hacimli bir kapta bulunan gerçek gazın yaptığı basınç ideal gaza göre daha düşüktür. Çünkü, düşük sıcaklıkta gerçek gazların tanecikleri arası çekim kuvvetleri artar ve taneciklerin kabın iç çeperlerine birim zamandaki çarpma sayısı azalır. Dolayısıyla basınç azalır. (Şekil 3-11)
Düşük sıcaklıkta, ideal pistonlu kaba doldurulan gerçek gazın hacmi, aynı sıcaklıktaki ideal gazdan daha fazladır. ideal gazlarda gaz taneciklerinin hacmi ihmal edilir. Ancak, düşük sıcaklıktaki gerçek gazın kapladığı hacim yanında kendi taneciklerinin hacmi de eklenince toplam hacim ideal gaz için beklenenden daha fazla olur. (Şekil 3-12)
Gerçek Gazların İdeale Yakınlıklarının Karşılaştırılması
Apolar ve küçük tanecikli gazlar, polar ve büyük tanecikli gazlara göre ideale daha yakındır.
Gaz—Buhar ve Kritik Sıcaklık
Günlük hayatta “buhar” kavramını daha çok suyun gaz hali için kullanırız. Gerçekte buhar ve gaz kavramları birbirinden farklıdır.
Bilindiği gibi sıvılar her sıcaklıkta buharlaşırlar. Isıtılan bir sıvı ise bir süre sonra kaynama noktasına ulaşarak daha yoğun bir şekilde buharlaşmaya başlar. Gereken ısı verilirse sıvının tamamı buhar fazına geçer. Buhar fazındaki bir madde soğutularak yeniden sıvılaştırılabileceği gibi kaynama noktasının üzerindeki bir sıcaklıkta soğutmadan, pistonlu bir kap içinde yüksek basınç altında sıkıştırılarak da sıvılaştırılabilir. Ancak, her sıvı buharı için basınçla sıvılaştırma belirli bir sıcaklıkta mümkündür.
Faz Diyagramları
Saf bir maddenin katı, sıvı ve buhar fazları arasındaki geçişlerini, sıcaklık ve basınca bağlı olarak gösteren grafiklere faz diyagramı denir.
Herhangi bir maddenin faz diyagramı, 0 maddenin farklı basınç ve sıcaklık değerlerinde hangi fazının daha kararlı olduğunu gösterir.
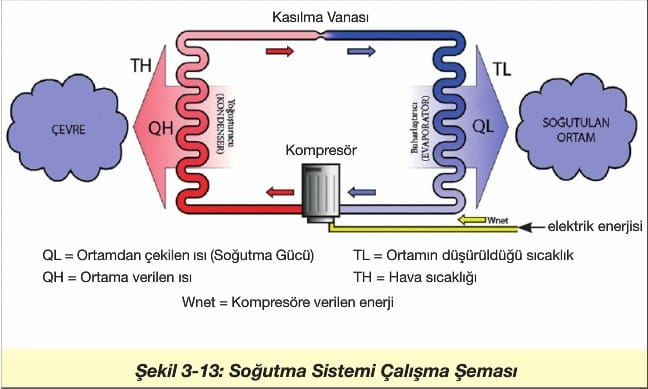
Soğutma Sistemleri
Soğutma, bir maddenin veya sistemin sıcaklığını bulunduğu ortamın sıcaklığının altına indirmektir. Bunu gerçekleştirebilmek için soğutulacak sistemden ısı çekilmesi gerekir. Bunun için, soğutucu akışkanlar kullanılır.
Joule—Thomson Olayı
Gazlar aniden genleştiklerinde moleküller birbirlerinden uzaklaşırlar ve ortalama hızları azalır. Genleşirken moleküller arası çekim kuvvetlerini yenmek için gaz tanecikleri kendi öz ısılarını kullandıklarından gaz soğur. Ani olarak genle en gazların kendi kendilerine soğumaları şeklinde gerçekleşen bu olaya Joule Thomson olayı denir.
Bu prensipten günlük hayatta soğutma sistemlerinde yararlanırız. Bir tekerleği şişirirken, sıkışan gazdan dolayı pompanın alt kısmı ısınırken, siboptan geçerek tekerleğin içinde aniden genişleyen gazdan dolayı sibopun sıcaklığı düşer. Bu durum da Joule-Thomson olayıyla açıklanır.