Bileşiklerin Adlandırılması 9. Sınıf Kimya
Bileşiklerin adlandırılması, elementlerin bir araya gelerek oluşturduğu kimyasal bileşiklerin isimlendirilmesini içerir. 9. sınıf kimya müfredatında, bileşiklerin nasıl adlandırıldığı ve bu süreçte hangi kuralların kullanıldığı öğretilir. Bileşiklerin adları, elementlerin birleşme şekline ve türüne bağlı olarak belirlenir.
Bileşiklerin Adlandırılması
- Bir bileşik, iyonlar arasındaki elektrostatik çekim kuvvetleri sonucunda oluşabilir (iyonik bağlı bileşik); ametal atomları arasında elektron ortaklaşması ile de meydana gelebilir (kovalent bağlı bileşik).
- İyonik bağlı bileşiklerin formüllerini doğru bir şekilde belirlemek ve adlandırmak için katyon ve anyonlar tanınmalıdır.
Bazı Katyon Adları
| Sembolü | Adı |
|---|---|
| Li⁺ | Lityum |
| Na⁺ | Sodyum |
| K⁺ | Potasyum |
| Rb⁺ | Rubidyum |
| Cs⁺ | Sezyum |
| Mg²⁺ | Magnezyum |
| Ca²⁺ | Kalsiyum |
| Sr²⁺ | Stronsiyum |
| Ba²⁺ | Baryum |
| Al³⁺ | Alüminyum |
| Zn²⁺ | Çinko |
| NH₄⁺ | Amonyum |
Bazı Anyon Adları
| Sembolü | Adı |
|---|---|
| F⁻ | Florür |
| Cl⁻ | Klorür |
| Br⁻ | Bromür |
| I⁻ | İyodür |
| S²⁻ | Sülfür |
| N³⁻ | Nitrür |
| C⁴⁻ | Karbür |
| H⁻ | Hidrür |
| O²⁻ | Oksit |
| SO₄²⁻ | Sülfat |
| NO₃⁻ | Nitrat |
| CO₃²⁻ | Karbonat |
| PO₄³⁻ | Fosfat |
| OH⁻ | Hidroksit |
| CN⁻ | Siyanür |
| HCO₃⁻ | Bikarbonat |
| CH₃COO⁻ | Asetat |
İyonik bağlı bileşikler, katyonlar ile anyonlar arasındaki elektrostatik çekim sonucu oluşurken, kovalent bağlı bileşikler ametal atomlarının elektronları ortak kullanmasıyla meydana gelir.
Örnekler:
- KNO₃ bileşiği, K⁺ katyonu ve NO₃⁻ anyonundan oluşan iyonik bir bileşiktir.
- C₆H₁₂O₆ bileşiği ise C, H ve O ametal atomlarından oluşan kovalent bağlı bir bileşiktir.
Bileşiklerin Sistematik Adlandırılması
Bileşikler iki temel şekilde adlandırılır:
- İyonik Bağlı Bileşik: Kation adı + Anion adı şeklinde adlandırılır.
- Kovalent Bağlı Bileşik (Moleküler Yapılı Bileşik): İlk ametalin Latince sayısı + İlk ametalin adı + İkinci ametalin Latince sayısı + İkinci ametalin anion adı şeklinde adlandırılır.
- Kovalent bağlı bileşiklerin formülleri yazılırken, genellikle ilk yazılan ametal molekülün pozitif ucunu, ikinci yazılan ametal ise negatif ucunu temsil eder. Bir başka deyişle, genellikle elektronegatifliği düşük olan element önce yazılır.
- NH3, PH3, CH4 gibi bileşiklerin formüllerinde ise istisnalar söz konusu olabilir. Bu tür bileşiklerin genellikle yaygın adları kullanılır.
Rakamların Latince Adları
| Rakam | Latince Adı |
|---|---|
| 1 | Mono |
| 2 | Di |
| 3 | Tri |
| 4 | Tetra |
| 5 | Penta |
| 6 | Hekza |
| 7 | Hepta |
| 8 | Okta |
Moleküler yapılı bileşiklerde oksit adlandırmasında “mono-“, “tetra-“, “penta-” gibi önekler kullanıldığında, sondaki sesli harf genellikle düşer.
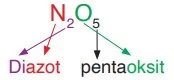
- N₂O : Diazot monoksit
- N₂O₅ : Diazot pentoksit
Çözümlü Örnek Sorular
Soru 1:
Aşağıdaki bileşiklerden hangisinin adı doğrudur?
A) CO₂ → Karbon monoksit
B) H₂O → Dihidrojen oksit
C) NH₃ → Amonyak
D) SO₃ → Sülfür trioksit
Çözüm:
CO₂ karbon dioksit, H₂O yaygın adıyla su, NH₃ ise amonyak olarak bilinir. SO₃ bileşiği ise doğru olarak kükürt trioksit olarak adlandırılır, sülfür trioksit değil.
Sonuç: C) NH₃ → Amonyak
Soru 2:
K₂O bileşiği nasıl adlandırılır?
A) Potasyum oksit
B) Potasyum dioksit
C) Potasyum trioksit
D) Potasyum hidroksit
Çözüm:
K₂O, iki potasyum atomu ve bir oksijen atomundan oluşur ve potasyum oksit olarak adlandırılır.
Sonuç: A) Potasyum oksit
Soru 3:
HCl bileşiğinin sulu çözeltisi nasıl adlandırılır?
A) Hidroklorik asit
B) Klorik asit
C) Sülfürik asit
D) Asetik asit
Çözüm:
HCl bileşiği, sulu çözeltisi olduğunda hidroklorik asit olarak adlandırılır.
Sonuç: A) Hidroklorik asit
Soru 4:
NaHCO₃ bileşiği hangi isimle bilinir?
A) Sodyum karbonat
B) Sodyum bikarbonat
C) Sodyum hidroksit
D) Sodyum klorür
Çözüm:
NaHCO₃ bileşiği, günlük hayatta kabartma tozu olarak bilinen sodyum bikarbonat olarak adlandırılır.
Sonuç: B) Sodyum bikarbonat
Özet:
Bileşiklerin Adlandırılma Yöntemleri
- İyonik Bileşikler
- İyonik bileşikler, metal ve ametallerin bir araya gelerek oluşturduğu bileşiklerdir. Metaller elektron vererek pozitif yüklü iyonlar (katyon), ametaller ise elektron alarak negatif yüklü iyonlar (anyon) oluştururlar.
- Adlandırma Kuralları:
- İlk olarak metalin (katyonun) adı yazılır.
- Sonra ametalin (anyonun) adı yazılır ve sonuna “-ür” veya “-it” gibi ekler eklenir.
- Eğer element bir grup iyonu içeriyorsa, iyon adı olduğu gibi yazılır.
Örnekler:
- NaCl → Sodyum Klorür
- MgO → Magnezyum Oksit
- CaSO₄ → Kalsiyum Sülfat
- Kovalent Bileşikler
- Kovalent bileşikler, ametaller arasında elektron paylaşımıyla oluşur. Kovalent bileşiklerin adlandırılmasında sayı önekleri kullanılır.
- Adlandırma Kuralları:
- İlk atomun adı aynen yazılır.
- İkinci atomun adı “-ür” veya “-it” eki alır.
- Atomların sayısını belirtmek için “mono”, “di”, “tri” gibi önekler kullanılır.
Örnekler:
- CO → Karbon Monoksit
- CO₂ → Karbon Dioksit
- N₂O → Diazot Monoksit
- Asitlerin Adlandırılması
- Asitler, genellikle hidrojen iyonları (H⁺) içeren bileşiklerdir. Bu bileşiklerin adlandırılması, içerdikleri anyonlara göre yapılır.
- Adlandırma Kuralları:
- Eğer anyon “hidrojen” ile başlıyorsa, “hidro-” öneki kullanılır.
- “-ür” veya “-it” ekine sahip anyonlar “-ik asit” ile sonlandırılır.
Örnekler:
- HCl → Hidroklorik Asit
- H₂SO₄ → Sülfürik Asit
- HNO₃ → Nitrik Asit
- Bazların Adlandırılması
- Bazlar, hidroksit iyonu (OH⁻) içeren bileşiklerdir. Genellikle metal katyonlarının adı ile hidroksit (OH⁻) anyonu birleşir.
- Adlandırma Kuralları:
- Metal katyonunun adı yazılır.
- Sonuna “hidroksit” eklenir.
Örnekler:
- NaOH → Sodyum Hidroksit
- KOH → Potasyum Hidroksit
- Ca(OH)₂ → Kalsiyum Hidroksit
Çözümlü Sorular
Soru 1: NaCl bileşiğinin adını yazın.
Çözüm: NaCl, sodyum (Na) ve klor (Cl) elementlerinden oluşan bir iyonik bileşiktir. Na⁺ katyonu, Cl⁻ anyonuyla birleşir ve adlandırma kurallarına göre “Sodyum Klorür” olur.
Soru 2: CO₂ bileşiğinin adını yazın.
Çözüm: CO₂, karbon (C) ve oksijen (O) elementlerinden oluşan kovalent bir bileşiktir. “Di” öneki, iki oksijen atomunu belirtir. Bu nedenle adı “Karbon Dioksit” olur.
Soru 3: H₂SO₄ bileşiğinin adını yazın.
Çözüm: H₂SO₄, sülfat (SO₄²⁻) anyonunu içerir. Adlandırma kurallarına göre, sülfat içeren asitlerin adı “-ik asit” ile biter. Bu yüzden bileşiğin adı “Sülfürik Asit” olur.
Soru 4: KOH bileşiğinin adını yazın.
Çözüm: KOH, potasyum (K) ve hidroksit (OH⁻) iyonlarından oluşan bir bazdır. Bu nedenle adı “Potasyum Hidroksit” olur.
Sonuç
Bileşiklerin adlandırılması, elementlerin kimyasal yapısını ve bağlarını anlamada önemli bir adımdır. İyonik, kovalent bileşikler, asitler ve bazlar adlandırma kurallarıyla doğru şekilde isimlendirilir. Bu kurallar, kimyasal bileşiklerin nasıl oluştuğunu anlamamıza yardımcı olur ve kimya dilinde doğru iletişim kurmayı sağlar.