Periyodik Sistem ve Elektron Dizilimleri 11.Sınıf Kimya
ELEKTRON DİZİLİMLERİ
Elektronlar orbitallere atomun enejisi en az olacak şekilde yerleştirilir. Bu durum atomun en kararlı yapısının gösterimidir.
Eletronlar orbitallere yerleştirilirken Madelung-Klechkowski kuralı olarak bilinen ilkeye göre sıralanır.
Buna göre;
1. Orbitallerin enerjileri (n + 4) değerinin artmasıyla artar.
2. (n + l) değerlerinin eşit olması durumunda “n” sayısı büyük olan orbitalin enerjisi de büyük olur.
Birkaç özel durum dışında elektronlar orbitallere şu sıra ile yerleşir.
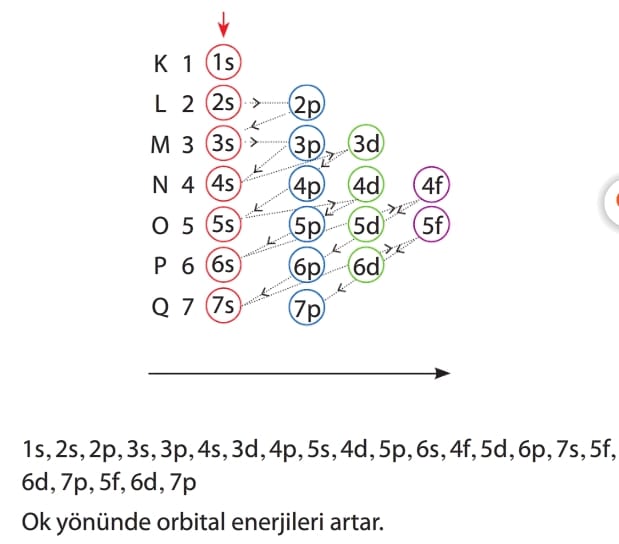
Aufbau İlkesi
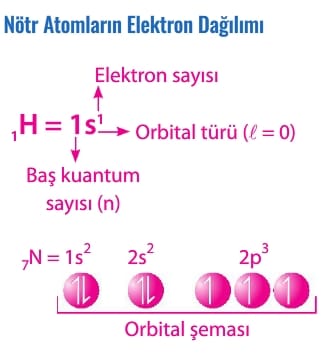
Elektronlar orbitallere artan enerji sırasını izleyerek yerleşir. Elektronlar 1s orbitalinden başlayarak enerjisi artacak şekilde sıralanır.
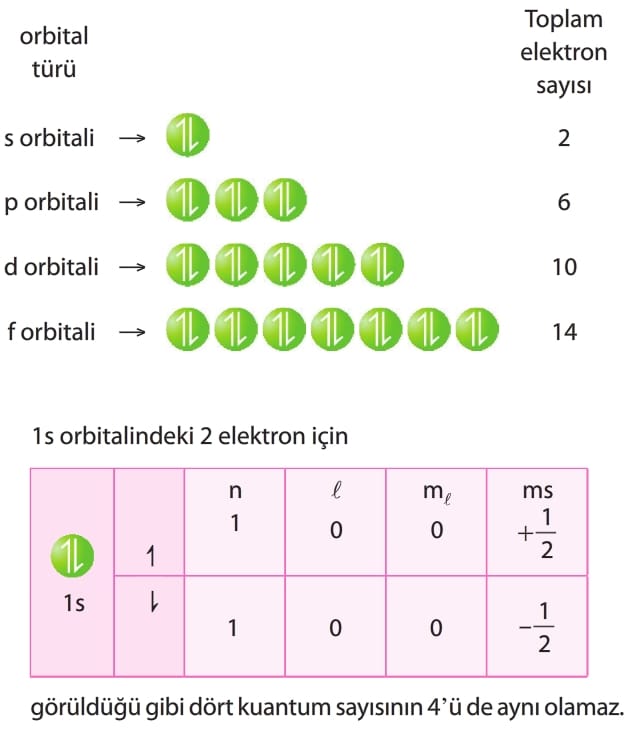
Pauli İlkesi:
Bir atomda tüm kuantum sayıları (n, l, ml, ms aynı olan iki elektron bulunmaz.
Bir orbitalde en fazla iki elektron bulunur ve bu iki elektron orbitale zıt spinli olarak yerleşir.
![]()
Hund Kuralı
Bu kurala göre elektronlar eş enerjili orbitallere öncelikle birer birer yerleşir, kalan elektronlar tek elektron içeren orbitallere zıt yönlü olarak yerleşir.





Çözümlü Örnek Test Soruları
Elementlerin periyodik tabloda nasıl dizildiği ve elektronlarının nasıl dağıldığı, periyodik özelliklerin temelini oluşturur.
1. Aşağıdakilerden hangisi aynı periyotta bulunan elementlerin ortak özelliğidir?
A) Atom numaralarının aynı olması
B) Enerji seviyelerinin aynı olması
C) Proton sayılarının aynı olması
D) Elektron dizilimlerinin aynı olması
Çözüm: Aynı periyotta bulunan elementler aynı enerji seviyesinde elektron bulundurur. Cevap B.
2. Bir atomun elektron dizilimi 1s² 2s² 2p⁶ 3s² 3p⁵ ise bu atomun periyodik tabloda hangi periyotta olduğu söylenebilir?
A) 1
B) 2
C) 3
D) 4
Çözüm: 3. enerji seviyesindeki elektronlardan dolayı bu atom 3. periyotta yer alır. Cevap C.
3. Elektron dizilimi [Ne] 3s² 3p⁴ olan bir element periyodik tabloda hangi grupta yer alır?
A) 14. grup
B) 16. grup
C) 18. grup
D) 17. grup
Çözüm: 3p⁴ dizilimi, bu elementin 16. grupta yer aldığını gösterir. Cevap B.
4. Aşağıdaki atomlardan hangisinin son yörüngesinde 1 elektron bulunur?
A) Oksijen
B) Flor
C) Sodyum
D) Magnezyum
Çözüm: Sodyumun (Na) elektron dizilimi 1s² 2s² 2p⁶ 3s¹ olduğundan son yörüngede 1 elektron bulunur. Cevap C.
5. Aşağıdakilerden hangisi bir elementin grup numarasını belirler?
A) Proton sayısı
B) Elektron sayısı
C) Son yörüngedeki elektron sayısı
D) Nötron sayısı
Çözüm: Bir elementin son yörüngesindeki elektron sayısı, grup numarasını belirler. Cevap C.
6. Aşağıdaki elementlerden hangisi aynı periyot içinde daha büyük atom yarıçapına sahiptir?
A) Oksijen
B) Azot
C) Karbon
D) Flor
Çözüm: Aynı periyotta atom numarası arttıkça çekirdek çekimi artar ve atom yarıçapı küçülür. Karbon, bu elementler arasında en büyük yarıçapa sahiptir. Cevap C.