Elementleri Tanıyalım 11.Sınıf Kimya
Element Türleri
Periyodik sistemi oluşturan elementler metal, ametal, yarı metal ve asal (soy) gaz olmak üzere dört sınıfa ayrılır. Metaller periyodik tablonun sol ve orta kısımlarında, ametaller sağ üst kısımda bulunur. Yarı metaller, metaller ve ametaller arasında, asal (soy) gazlar ise periyodik tablonun en sağındadır. Element türlerinin periyodik sistemdeki konumları yanda gösterilmiştir.
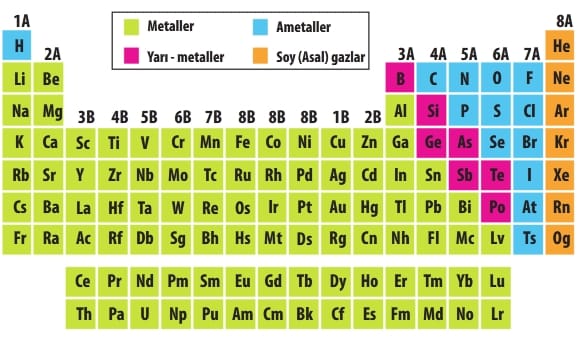
Element Türlerini Tanıyalım
Element türlerinin fiziksel ve kimyasal bakımdan belirgin farklar vardır.
Metallerin Genel Özellikleri
- 1A, 2A, 3A ve B gruplarında bulunurlar.
- Cıva hariç oda koşullarında katıdırlar.
- Isı ve elektriği iyi iletirler.
- Tel ve levha hâline getirilip işlenebilirler.
- Parlak görünümlüdürler.
- Erime ve kaynama noktaları oldukça yüksektir. a
- Elektron vermeye yatkındırlar.
- Artı yüklü kararlı iyon (katyon) oluştururlar.
- Gruplarına göre metallerin yükseltgenme basamakları aşağıdaki gibidir. 1A → 1+,2A → 2+,3A → 3+
- Kendi aralarında alaşım, ametallerle iyonik bileşik oluştururlar.
- Elementel hâlde atomik yapıya sahiptirler.
Ametallerin Genel Özellikleri
- 5A, 6A ve 7A gruplarında bulunurlar.
- Oda koşullarında katı, sıvı veya gaz hâlde olanları vardır.
- Grafit hariç elektriği iletmezler.
- Mat görünümlüdürler.
- Kırılgan olduklarından işlenemezler.
- Erime ve kaynama noktaları genellikle düşüktür.
- Elektron almaya ve ortaklaşa kullanmaya yatkındırlar.
- Eksi yüklü kararlı iyon (anyon) oluştururlar.
- Gruplarına göre ametallerin yükseltgenme basamakları aşağıdaki gibidir. 5A → 3- , 6A → 2-, 7A → 1-
- Kendi aralarında kovalent, metallerle iyonik bileşik oluştururlar.
- Elementel halde moleküllü yapıya sahiptirler.
Yarı Metallerin Genel Özellikleri
3A, 4A, SA ve 6A gruplarına dağılmışlardır.
Fiziksel özellikleri metallere kimyasal özellikleri ametallere benzer.
Oda koşullarında katıdırlar.
Parlak veya mattırlar.
Elektrik iletkenlikleri metallere göre daha düşüktür.
Metallerle alaşım ve iyonik bileşik, ametallerle kovalent bileşik oluştururlar.
Elementel hâlde atomik yapıya sahiptirler.
Soy (Asal) Gazların Genel Özellikleri
- 8A grubunda bulunurlar.
- Oda koşullarında gaz hâlindedirler.
- Elektriği iletmezler.
- Kararlı yapıdadırlar, tepkimeye yatkın değillerdir.
- Metallerle ve ametallerle bileşik oluşturmazlar.
- Elementel hâlde atomik yapılıdırlar.
Çözümlü Örnek Test Soruları
Elementlerin özellikleri ve bulundukları yerler kimyasal bağlar ve maddelerin yapısında önemli rol oynar. Periyodik tablo, bu elementlerin sınıflandırılmasında kullanılır.
1. Aşağıdakilerden hangisi bir ametal elementtir?
A) Demir
B) Bakır
C) Karbon
D) Çinko
Çözüm: Karbon (C) ametal elementtir. Cevap C.
2. Hangi element, periyodik tabloda halojenler grubunda yer alır?
A) Klor
B) Azot
C) Oksijen
D) Sodyum
Çözüm: Klor (Cl), halojenler grubunda yer alır. Cevap A.
3. Periyodik tabloda 1A grubunda yer alan elementler aşağıdaki özelliklerden hangisine sahiptir?
A) Yüksek erime noktaları
B) Ametalik özellikler
C) Metalik özellikler
D) Negatif iyon yükü
Çözüm: 1A grubu elementleri alkali metaller olup, metalik özelliklere sahiptir. Cevap C.
4. Aşağıdaki elementlerden hangisi soy gazdır?
A) Hidrojen
B) Helyum
C) Klor
D) Kükürt
Çözüm: Helyum (He), soy gazdır. Cevap B.
5. Hangi elementin kimyasal sembolü “Na”dır?
A) Sodyum
B) Nikel
C) Neon
D) Niyobyum
Çözüm: Na, Sodyum’un sembolüdür. Cevap A.
6. Aşağıdaki elementlerden hangisinin oda sıcaklığında sıvı halde bulunur?
A) Cıva
B) Altın
C) Gümüş
D) Bakır
Çözüm: Cıva (Hg), oda sıcaklığında sıvı halde bulunan bir metaldir. Cevap A.
Burak, yanlış olan nedir?
Şunu düzeltin ya her ikide bir yanlış yazıyorsunuz benim başıma patlıyor şunu düzeltin lütfen