Kuvvetli Asit-Baz Titrasyonu 11. sınıf kimya
- Bir asit ile bir bazın çözeltilerinin tepkimeye girerek H2O oluşturmasına nötrleşme (nötralleşme) denir.
- Nötrleşme tepkimelerinde;
H+(suda) + OH–(suda) → H2O(s)
net iyon tepkimesi gerçekleşir. - Nötrleşme tepkimelerinde aşağıdaki durumlar oluşabilir:
→ Tepkime sonucunda H+ ve OH– iyonlarının mol sayıları arasında 25 0C de,

Bilgi: Nötrleşme tepkimelerinde işlemler asitten gelen H+ ve bazdan gelen OH– iyonlarının mol sayılan ile yapılır.
- Kuvvetli Asit ve Kuvvetli Baz Çözeltilerinin Titrasyonu:
→ Derişimi bilinen asit veya baz çözeltisiyle derişimi bilinmeyen asit ya da baz çözeltisinin indikatör yardımıyla derişiminin bulunmasına titrasyon denir.
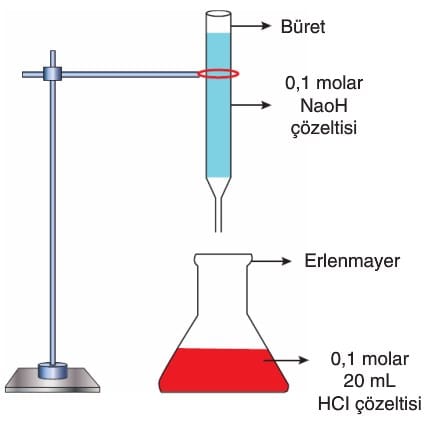
→ Titrasyon işlemlerinde, büretten akıtılan çözeltinin (titrantın) hacmine karşılık karışımın pH grafiği çizilebilir. Bu grafikteki eğrilere titrasyon eğrileri denir.
→ Büretten ilave edilen bazın hacmi belirlenip harcanan OH– mol sayısı ve tepkime sonrası H+ iyonları derişimi ve pH değeri bulunabilir.
→ Titrasyon işlemlerinde asit ve bazın tamamen tükendiği noktaya eşdeğerlik noktası denir. Bu noktada asitten gelen H+ ve bazdan gelen OH– iyonlarının mol sayıları birbirine eşittir.
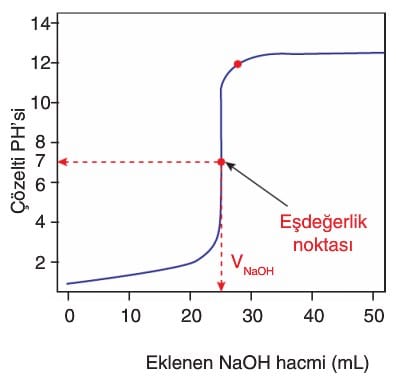
→ Eşdeğerlik noktasında H+ ve OH– iyonlarının molar derişimleri eşit olmayabilir. Çünkü oluşan tuz nötr olmayabilir.
→ Titrasyonda eşdeğerlik noktası indikatörler yardımıyla ya da pH metre cihazı ile bulunur.
→ Bir çözeltideki H+ iyonu derişimine göre renk değiştiren organik boyar maddelere indikatör ya da belirteç denir. - Bir atom ya da molekül kütlesinin o maddenin tesir değerliğine bölümüne eşdeğer kütle denir.
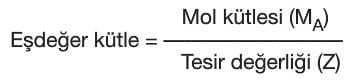
- Bir maddenin kütlesinin 0 maddenin eşdeğer kütlesine bölümüne eşdeğer sayısı denir.
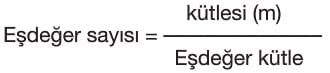
Titrasyon video 11. sınıf Hocalara Geldik
BİR YORUM YAZIN
ZİYARETÇİ YORUMLARI - 2 YORUM


Sen once misinizi ayri yaz
Sakamisiniz tyt 15 haziran