Dipol-Dipol Etkileşimi 9. Sınıf Kimya
Moleküller arasındaki etkileşimler, maddelerin fiziksel ve kimyasal özelliklerini belirleyen önemli faktörlerdir. Dipol-dipol etkileşimi, polar moleküller arasındaki elektrostatik çekim kuvvetlerinden kaynaklanan bir etkileşimdir. Moleküllerin bir tarafı pozitif, diğer tarafı negatif yük taşıdığında bu zıt yükler birbirini çeker. Bu etkileşimler, özellikle polar moleküllerin davranışlarını, kaynama ve erime noktalarını anlamada kritik öneme sahiptir.
Dipol-Dipol Etkileşimi
Kalıcı dipol oluşturan moleküller arasında kalıcı kısmen negatif (8-) ve kalıcı kısmen pozitif (8+) uçları arasında meydana gelen elektrostatik çekim kuvvetleridir. Kısaca polar moleküller arasında görülür.
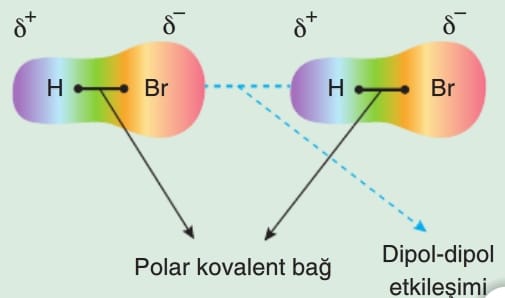
Polar kovalent bağ koparsa kimyasal özeli değişir. Dipol-dipol etkileşimi koparsa fiziksel özellik değişir.
Dipol-dipol etkileşimi içeren moleküllere HCI, SO2, CO ve H2S gibi polar moleküller örnek verilebilir.
Çözümlü Örnek Sorular
Soru 1
Dipol-dipol etkileşimi hangi tür moleküller arasında meydana gelir?
A) Apolar moleküller
B) Polar moleküller
C) İyonik bileşikler
D) Apolar ve iyonik bileşikler
Çözüm:
Dipol-dipol etkileşimi, kalıcı dipol momentine sahip polar moleküller arasında oluşur. Polar moleküllerin pozitif ve negatif uçları arasında çekim kuvveti vardır.
Doğru cevap: B
Soru 2
Aşağıdaki moleküllerden hangisi dipol-dipol etkileşimi gösterebilir?
A) CO2
B) H2
C) HCl
D) O2
Çözüm:
HCl molekülü polar bir moleküldür ve pozitif uç ile negatif uç arasında dipol-dipol etkileşimi meydana gelir. Diğer moleküller apolar yapıdadır.
Doğru cevap: C
Soru 3
Dipol-dipol etkileşimi kuvvetinin büyüklüğü neye bağlıdır?
A) Molekülün polaritesine
B) Molekül büyüklüğüne
C) Molekül kütlesine
D) İyonik bağın gücüne
Çözüm:
Dipol-dipol etkileşiminin gücü, molekülün polaritesi, yani dipol momentinin büyüklüğüne bağlıdır. Polarite arttıkça bu etkileşim daha güçlü hale gelir.
Doğru cevap: A
Soru 4
Aşağıdaki olaylardan hangisi dipol-dipol etkileşimleri sayesinde gerçekleşir?
A) Suyun yüksek kaynama noktası
B) O2 ve N2 gazlarının karışımı
C) NaCl kristalinin oluşumu
D) Metan gazının kararlılığı
Çözüm:
Suyun yüksek kaynama noktası, polar moleküller arasında meydana gelen dipol-dipol etkileşimleri nedeniyle oluşur.
Doğru cevap: A
Soru 5
Dipol-dipol etkileşimi hangi molekül çiftleri arasında en güçlüdür?
A) CH4 ve H2
B) HCl ve HF
C) O2 ve N2
D) CO2 ve CH4
Çözüm:
HCl ve HF, polar moleküllerdir ve aralarındaki dipol-dipol etkileşimi oldukça güçlüdür.
Doğru cevap: B