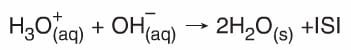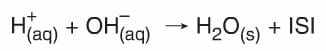Asitler ve Bazların Tepkimeleri 10. sınıf kimya
Bir asitin sulu çözeltisi ile bir bazın sulu çözeltisi karıştırılırsa asitten gelen hidronyum (H3O+) iyonu ile bazdan gelen hidroksit (OH–) iyonu tepkimeye girerek suyu oluştururlar.
Bu tepkime pratik olarak aşağıdaki gibi de yazılabilir.
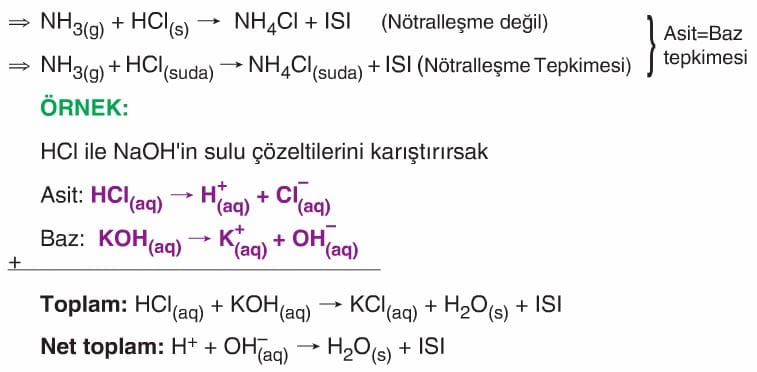
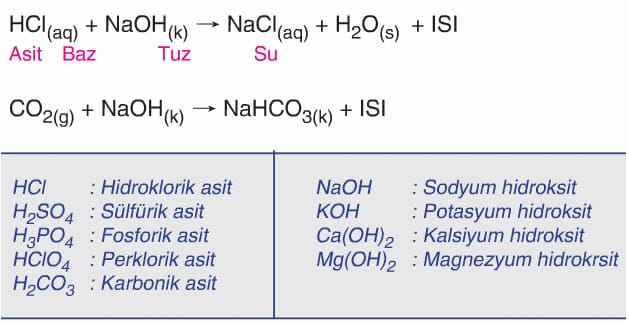
- Asidin anyonu ile bazın katyonu da birleşerek Tuz olarak sınıflandırılan madde oluşur.
- Asitler ile bazların ya sulu ortamda ya da su üreterek oluşturduğu tepkimelere Nötralleşme Tepkimeleri denir.
- Her asit-baz tepkimesi nötralleşme tepkimesi olmaz. Ancak her nötralleşme tepkimesi asit-baz tepkimesidir.
- Bütün asit baz tepkimelerinde net iyon (nötralleşme) tepkimesi aynıdır. (Ortaktır).
Net Nötralleşme Tepkimesi:
H+(aq) + OH–(aq) → H2O(s) + ISI - Bütün asit-baz tepkimeleri ekzotermiktir.
- Bütün asit-baz tepkimelerinden her zaman tuz oluşur. Ancak su oluşmayabilir.
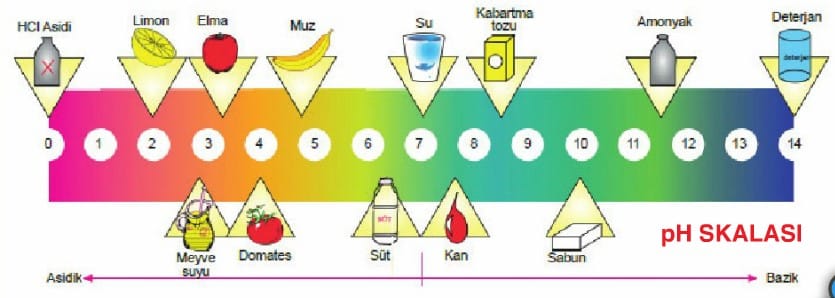
Nötralleşme Tepkimeleri ve pH Kavramı
Bir maddenin asit mi yoksa baz mı olduğunu sulu çözeltisindeki H3O+ (ya da H+) ve OH– iyonlarının birbirine göre çokluğu belirler.
- H3O+ ve OH– iyonları saf suda bile bulunur ve sayıca birbirine eşittir.
nH3O+ = nOH– - H+(H3O+) iyonları sayıca OH– iyonlarından fazla ise çözelti asidik
- OH– iyonları, H3O+ (ya da H+) iyonundan fazla ise çözelti baziktir.
- pH değeri bir maddenin asitlik derecesinin bir ölçüsüdür.
- pOH değeri bir maddenin bazlık derecesinin bir ölçüsüdür.
- Bir çözeltinin pH değeri için
→ nH+ = nOH– ise çözelti nötr pH= 7 = pOH
→ nH+ > nOH– ise çözelti asidik pH < 7 < pOH
→ nH+ < nOH– ise çözelti bazik pH > 7 > pOH - 25°C’de sulu bir çözeltide: pH + pOH = 14
- Bir asit çözeltisine su ilave edilirse pH değeri artar.
- Bir baz çözeltisine su ilave edilirse pH değeri azalır.
- Saf suya asit ilave edilirse pH değeri azalır.
- Saf suya baz ilave edilirse pH değeri artar.
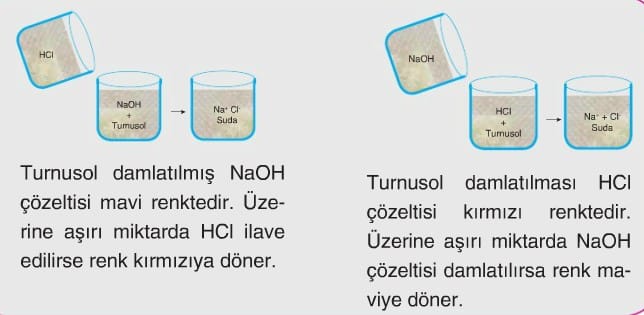
- Asit-baz tepkimeleri özellikle renk değişimi üzerinden takip edilir.
- Renk değişimini takip edebilmek için asit ya da bazdan birinin içine uygun indikatör konulur. Daha sonra bu karışımın üzerine diğer asit ya da baz ilave edilerek renk değişimi takip edilir.
Asit ve Bazların Metallerle Tepkimesi
Asitlerin Metallerle Tepkimesi
- Aktif metaller (Alkali ve toprak alkali metaller gibi) her türlü asit ile tepkime verip metalin tuzunu ve H2 gazını oluştururlar.
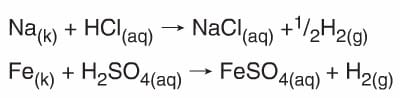
- Oksijeni olmayan anorganik asitler yarı soy (Ca, Ag, Hg) ve soy (Pt, Au) metallerle tepkime vermez.
Cu + HCl → Tepkime Yok
Ag + HBr → Tepkime yok. - Asitler karbonatlı (CO32-) ve bikarbonatlı (HCO3–) bileşiklerle tepkimelerinden tuz, CO2 ve H2O oluştururlar.
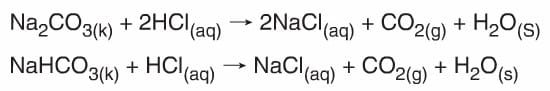
- Asitler metal oksitler tepkimelerinden tuz ve H2O oluşur.
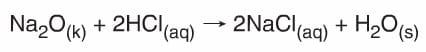
Bazların Metallerle Tepkimeleri
Kuvvetli Bazlar amfoter metallerle (Zn, Al, Cr, Pb, Sn…) tepkime vererek çift katyonlu tuz ve H2 gazı oluştururlar.
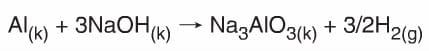
Asit ve Bazların Aşındırıcılığı
Asitler ve bazlar tepkime verdikleri her şeyi aşındırırlar. Canlı dokuları, binaları, tarihi eserleri aşındırıcı etkiye Korozif etki de denir.
Çözümlü Örnek Test Soruları
2. BÖLÜM: Asitlerin ve Bazların Tepkimeleri
- Aşağıdaki tepkimelerden hangisi bir asit-baz tepkimesidir?
A) NaOH + HCl → NaCl + H₂O
B) C + O₂ → CO₂
C) N₂ + 3H₂ → 2NH₃
D) H₂ + Cl₂ → 2HClÇözüm: NaOH bir baz, HCl ise bir asittir. Bu tepkime bir nötrleşme tepkimesidir. Doğru cevap A‘dır. - Asit ile baz tepkimeye girdiğinde hangi ürün oluşur?
A) Tuz ve su
B) Tuz ve hidrojen
C) Su ve hidrojen
D) Karbon dioksit ve suÇözüm: Asit-baz tepkimelerinde tuz ve su oluşur. Doğru cevap A‘dır. - H₂SO₄ + 2NaOH → Na₂SO₄ + 2H₂O tepkimesinde, oluşan tuz nedir?
A) NaCl
B) Na₂SO₄
C) K₂SO₄
D) NaNO₃Çözüm: Tepkimede NaOH (baz) ve H₂SO₄ (asit) reaksiyona girerek Na₂SO₄ (sodyum sülfat) tuzunu oluşturur. Doğru cevap B‘dir. - Aşağıdaki asit-baz tepkimelerinden hangisi doğru dengelenmiştir?
A) HCl + NaOH → NaCl + H₂O
B) H₂SO₄ + NaOH → Na₂SO₄ + H₂O
C) HCl + KOH → KCl + H₂O
D) HNO₃ + KOH → KNO₃ + H₂OÇözüm: Tüm tepkimelerden B yanlış dengelenmiştir, diğer tepkimeler doğru verilmiştir. Bu nedenle doğru cevap A, C ve D olacaktır. - HCl + NaOH tepkimesinde oluşan suyun molekül formülü nedir?
A) H₂O
B) NaH
C) OH
D) H₂O₂Çözüm: Bu nötrleşme tepkimesinde su (H₂O) oluşur. Doğru cevap A‘dır. - Bir asit ile baz tepkimeye girdiğinde aşağıdaki maddelerden hangisi kesinlikle oluşmaz?
A) Su
B) Tuz
C) H₂
D) OH⁻Çözüm: Asit-baz tepkimeleri sonucunda H₂ (hidrojen gazı) oluşmaz, su ve tuz oluşur. Doğru cevap C‘dir.
BİR YORUM YAZIN
ZİYARETÇİ YORUMLARI - 0 YORUM