Hidrojen Bağı 9. Sınıf Kimya
Kimyasal bağlar, atomlar ve moleküller arasındaki etkileşimleri açıklayan temel unsurlardır. Hidrojen bağı, moleküller arasında bulunan güçlü bir çekim kuvvetidir. Bu bağ, hidrojen atomunun, yüksek elektronegatifliğe sahip bir atom (örneğin, oksijen, flor, azot) ile yaptığı bağlar sonucu oluşur. Hidrojen bağları, su gibi birçok maddenin fiziksel ve kimyasal özelliklerini belirlemede önemli bir rol oynar.
Hidrojen Bağları
Hidrojen atomu elektronegatifliği yüksek olan bir atomla (F, O, N) kovalent bağla bağlandıktan sonra bağdaki elektronlar elektronegatifliği yüksek atom tarafından çekilir. Bunun sonucunda molekülde kutuplaşma meydana gelir.
Elektronsuz kalan hidrojen atomuyla komşu moleküldeki ortaklanmamış elektron çifti arasında elektrostatik çekim kuvveti oluşur.
Bu şekilde hidrojen atomu köprü atom hâline gelir.
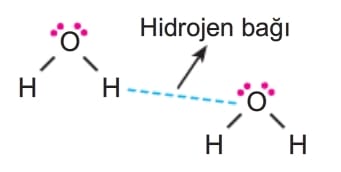
HF, H2O, NH3 ve CH3OH gibi bileşiklerin molekülleri arasında hidrojen bağı vardır.
CF4, CH3—O—CH3 ve CH3 – NO2 gibi hidrojen atomunun elektronegatifliği yüksek atomla (F, O, N) bağlanmadığı moleküllerde hidrojen bağı bulunmaz.
Hidrojen bağları, Van der Waals bağlarından daha güçlüdür.
Çözümlü Örnek Sorular
Soru 1
Hidrojen bağının oluşabilmesi için hangi atomlar arasında bağ oluşması gerekir?
A) Hidrojen ve oksijen
B) Hidrojen ve flor
C) Hidrojen ve azot
D) Yukarıdakilerin hepsi
Çözüm:
Hidrojen bağları, hidrojen atomunun çok elektronegatif elementlerle (oksijen, flor, azot gibi) bağlanmasıyla oluşur. Bu nedenle doğru cevap tüm seçeneklerdir.
Doğru cevap: D
Soru 2
Aşağıdaki moleküllerden hangisinde hidrojen bağı oluşmaz?
A) H2O
B) NH3
C) HF
D) CH4
Çözüm:
Hidrojen bağı, hidrojenin elektronegatif bir elemente (O, N, F) bağlanmasıyla oluşur. CH4 molekülünde hidrojen karbonla bağlandığı için hidrojen bağı oluşmaz.
Doğru cevap: D
Soru 3
Hidrojen bağının, suyun kaynama noktası üzerinde nasıl bir etkisi vardır?
A) Kaynama noktasını düşürür
B) Kaynama noktasını artırır
C) Kaynama noktasını değiştirmez
D) Suyun donma noktasını yükseltir
Çözüm:
Hidrojen bağları, su molekülleri arasındaki çekim kuvvetlerini artırarak suyun kaynama noktasını yükseltir.
Doğru cevap: B
Soru 4
Aşağıdakilerden hangisi hidrojen bağı sayesinde açıklanabilir?
A) Su moleküllerinin buharlaşması
B) Buzun suyun üzerinde yüzmesi
C) Suyun yüksek yüzey gerilimi
D) Suyun düşük yoğunlukta olması
Çözüm:
Hidrojen bağları su moleküllerini bir arada tutarak yüzey geriliminin yüksek olmasını sağlar.
Doğru cevap: C
Soru 5
Hidrojen bağı kuvveti, aşağıdaki bağlardan hangisinden daha zayıftır?
A) Kovalent bağ
B) Van der Waals kuvveti
C) Dipol-dipol kuvveti
D) London kuvvetleri
Çözüm:
Hidrojen bağı, kovalent bağdan daha zayıf, ancak Van der Waals kuvvetlerinden daha güçlüdür.
Doğru cevap: A
Örnek:
Kimyasal türler arası etkileşimlerle ilgili olarak aşağıda verilen ifadelerden hangisi yanlıştır?
A) Hidrojen bağları zayıf etkileşimler kapsamındaki en güçlü olan etkileşim türüdür.
B) İki veya daha fazla atomun belirli oranlarda bir araya gelmesiyle oluşturduğu kimyasal türlere molekül denir.
C) Elektriksel yüklenme ya da çarpışmalar etkisiyle apolar moleküllerin veya soy gazların kısmi yük kazanmalarıyla oluşan kutuplaşmaya indüklenmiş dipol denir.
D) Ca2+ ile CH4 tanecikleri arasında iyon – indüklenmiş dipol etkileşimleri gözlenir.
E) London kuvvetleri (indüklenmiş dipol – indüklenmiş dipol etkileşimleri) yalnızca polar moleküller arasında gözlenir.
Çözüm: A,B,C ve D seçeneklerinde verilen tanımlamalar doğru iken E seçeneğinde verilen tanımlama yanlıştır. London kuvvetleri polar değil, apolar tanecikler arasında görülen zayıf etkileşimlerdir.
Yanıt E

Cok tesekurler