Elektron Katman Dizilimi 9. Sınıf Kimya
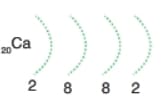
İlk 20 x element için elektron katman dağılımı.

Enerji seviyesi = Katman = Yörünge
n = Katman
n = 1. Katmanda en fazla 2e–
n = 2. Katmanda en fazla 8e–
n = 3. Katmanda en fazla 18e–
n = 4. Katmanda en fazla 32e– bulunur.
> Bunlar A grubu (Baş grup) elementleridir.
> Son katmanlarında 1, 2 ve 3 elektron bulunduranlar genellikle metaldir. Bileşik oluşumuna bu en dış kabuktaki (katmandaki) elektronları vererek katılırlar ve katyon olurlar.
> Son katmanda 5, 6 veya 7 elektron bulunduranlar genellikle ametaldir. Kararlı hale gelmek için genellikle elektron almak isterler ve anyon olurlar.
* Bir element elektron alarak yada elektron vererek e- dağılımını 2He ye benzetenler dublet kuralına uyarak kararlı hale gelmiş olur.
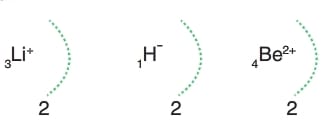
Dublet kısaca 2He’ nin elektron dağılımına benzemedir.
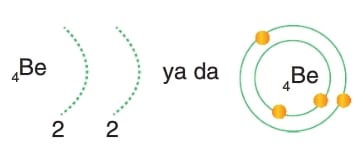
Son katmandaki 2 elektronu verip bir alt katmandaki 2 elektrona ulaşarak dublet kuralına uyar ve kararlı hale gelir. Helyumun elektron dağılımına ulaşmış olur.

* Elektron alarak ya da elektron vererek son katmanı 8 elektrona tamamlamak ise OKTET KURALIDIR. Yani He dışındaki soy gazların elektron dizilimine benzemedir. Kararlı yapıya ulaşmadır.
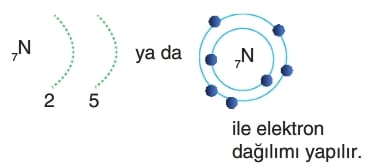
Burada son katman dikkate alınarak şu soru sorulur.
En dıştaki 5 elektron vermek mi kolay, ya da 3 elektron alınıp 8 elektrona tamamlamak mı kolay? Sayıca az olan yapılır genellikle.
O zaman azot 3e– alıp son katmanı 8 elektrona tamamlayarak oktet kuralına uyar ve kararlı hale ulaşır.


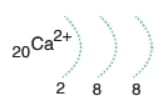
Kararlı hale gelmek için en diş kabuktaki 2 elektron verilir. Böylece elektron dağılımı 18A nın elektron dağılımına benzer. OKTET kuralına
uyar. Metaldir.
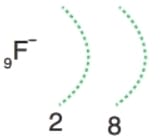
Kararlı hale gelmek için en dış katmanına 1 elektron alır. Elektron dağılımı 10Ne’nin elektron dağılımına benzer ve oktet kuralına uyar. Ametaldir.

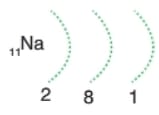
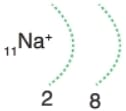
Kararlı hale gelmek için en dış katmandaki 1 elektronu verir. Elektron dağılımı 10Ne elektron dağılımına benzer ve OKTET kuralına uyar. Metaldir.
Kararlı hale gelmek için en diş katmana 2 elektron alır. Elektron dağılımı 18Ar nin elektron dağılımına benzer ve OKTET kuralına uyar. Ametaldir.
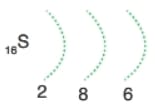
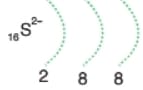
Çözümlü Örnek Test Soruları
Soru 1:
Atom numarası 26 olan bir elementin elektron diziliminde M katmanında kaç elektron bulunur?
A) 8
B) 12
C) 14
D) 18
E) 20
Çözüm:
Atom numarası 26 olan bir elementin elektron dizilimi 2, 8, 14, 2 şeklindedir. M katmanında 14 elektron bulunur.
Doğru cevap: C) 14
Soru 2:
Atom numarası 17 olan bir element için L katmanındaki elektron sayısı, K katmanındaki elektron sayısının kaç katıdır?
A) 1
B) 2
C) 3
D) 4
E) 5
Çözüm:
Atom numarası 17 olan elementin elektron dizilimi 2, 8, 7 şeklindedir. L katmanında 8, K katmanında 2 elektron vardır. 8 / 2 = 4 olduğu için L katmanındaki elektron sayısı, K katmanının 4 katıdır.
Doğru cevap: D) 4
Soru 3:
Bir atomda 3. enerji seviyesindeki (M katmanı) elektron sayısı 10 ise, bu atomun toplam elektron sayısı en az kaçtır?
A) 13
B) 15
C) 18
D) 21
E) 24
Çözüm:
M katmanında 10 elektron varsa, önceki katmanlarda maksimum elektron bulunması gerekir:
K katmanı: 2, L katmanı: 8, M katmanı: 10 → Toplam = 2 + 8 + 10 = 20 elektron
Doğru cevap: C) 18
Soru 4:
Bir atomda K, L, M katmanları sırasıyla 2, 8 ve 5 elektron içeriyorsa bu atomun atom numarası kaçtır?
A) 13
B) 15
C) 18
D) 22
E) 24
Çözüm:
Elektron sayısı toplamı K, L, ve M katmanlarının elektron sayılarına göre 2 + 8 + 5 = 15’tir, bu nedenle atom numarası 15’tir.
Doğru cevap: B) 15
Soru 5:
Atom numarası 12 olan bir elementin elektron dizilimi nedir ve bu atomun hangi katmanında elektron bulunmaz?
A) 2, 8, 2; N
B) 2, 6, 4; M
C) 2, 8, 2; M
D) 2, 8, 2; K
E) 2, 8, 2; L
Çözüm:
Atom numarası 12 olan elementin elektron dizilimi 2, 8, 2 şeklindedir. N katmanında elektron bulunmaz.
Doğru cevap: A) 2, 8, 2; N
Soru 6:
Atom numarası 29 olan bir elementin M katmanındaki elektron sayısı aşağıdakilerden hangisidir?
A) 8
B) 10
C) 12
D) 18
E) 20
Çözüm:
Atom numarası 29 olan elementin elektron dizilimi 2, 8, 18, 1 şeklindedir. M katmanında 18 elektron bulunur.
Doğru cevap: D) 18
Soru 7:
Bir atomun elektron dizilimi 2, 8, 18, 7 ise bu atomun kaçıncı katmanında tam dolmamış bir enerji seviyesi vardır?
A) 1
B) 2
C) 3
D) 4
E) 5
Çözüm:
Dördüncü katmanda 7 elektron vardır ve bu katman tam dolmamıştır.
Doğru cevap: D) 4
Soru 8:
Bir atomun elektron diziliminde en dış katmanda tek bir elektron bulunuyorsa, bu atomun elektron diziliminin hangi katman sayıları arasında olması beklenir?
A) 2, 8, 1
B) 2, 8, 8, 1
C) 2, 8, 18, 8, 1
D) 2, 8, 18, 18, 1
E) 2, 8, 18, 8, 2
Çözüm:
En dış katmanda 1 elektron olması, bu dizilimin bir örneği olarak 2, 8, 18, 8, 1 şeklindedir.
Doğru cevap: C) 2, 8, 18, 8, 1
Eyvallah.
Çok yardımcı oldu teşekkür ederim 🙂