Kovalent Bağ 9.Sınıf Kimya
9. Sınıf Kovalent Bağ Testleri
Ametal atomları arasında veya yarımetallerle ametal atomları arasında elektronların ortaklaşa kullanılması sonucu oluşan bağa kovalent bağ denir.
Lewis yapısında ortaklaşa kullanılan elektronlara bağlayıcı elektronlar denir. Bağ yapımına katılmayan elektronlara ise ortaklanmamış elektronlar denir. Kovalent bağlı maddelerin en küçük yapı taşı moleküldür.
Kovalent bağ ikiye ayrılır:
Polar Kovalent Bağ
Farklı ametal atomları arasında oluşan bağdır: H2O, CO2, NH3, HCI gibi.
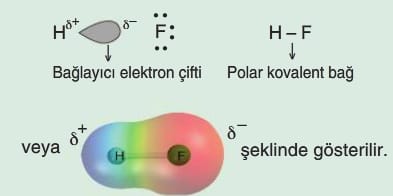
Farklı ametallerin elektronegatiflikleri farklı olduğu için molekülde (+) ve (—) kutuplanmalar olur. Elektronegatifliği büyük olan, elektronları daha çok çektiğinden kısmi negatif (8–), diğer atom ise kısmi pozitif (8+) yükle yüklenir. Böylece kalıcı dipoller (iki kutup) oluşur. Bu şekilde oluşan bağlara polar (kutuplu) kovalent bağ denir.
Örneğin, 1H ve 9F arasında oluşan bileşiği inceleyelim.
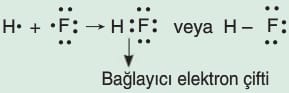
Florun elektronegatifliği büyük olduğundan bağlayıcı elektronlar daha çok flor tarafından çekilir.
Apolar Kovalent Bağ
Aynı ametal atomları arasında elektronların ortaklaşa kullanılması sonucu oluşan bağdır. Elektronlar aynı atomlar tarafından eşit çekileceğinden apolar (kutupsuz) kovalent bağ oluşur: N2, O2, H2, Cl2 gibi.
Örneğin, H atomları arasında H2 molekülünün oluşmasını inceleyelim.
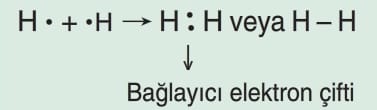
Elektronegatiflikler eşit olduğundan elektronlar iki atom tarafından da eşit çekilir.

Moleküllerin Polar ve Apolarlığı
Molekülde elektron yük dağılımı simetrikse yani dipol moment (bileşke kuvvet) sıfırsa molekül apolardır. Dipol moment sıfırdan farklıysa yani yük dağılımı asimetrikse molekül polardır.
Molekülde merkez atom üzerinde ortaklanmamış elektron çifti varsa molekül polardır.
Aşağıdaki moleküller incelendiğinde polar kovalent bağ olduğu görülür. Moleküldeki elektron yoğunluğu dengeli olduğundan dipol moment (bileşke kuvvet) sıfırdır. Dolayısıyla molekül apolardır.
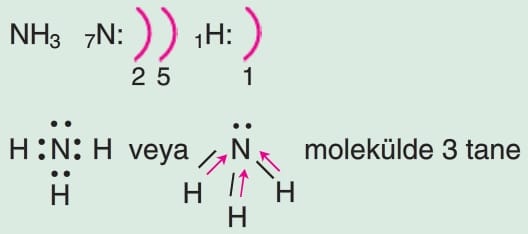
polar kovalent bağ vardır. Molekülde elektron yoğunluğu asimetrik olduğundan yani dipol moment sıfırdan farklı olduğundan molekül polardır.
Kovalent Bileşiklerin Özellikleri:
✔ Oda sıcaklığında genellikle gaz veya sıvıdır.
✔ Erime ve kaynama noktaları düşüktür.
✔ Suda çözünürlükleri değişkendir (polar olanlar suda çözünür).
✔ Elektrik akımını iletmezler (sulu çözeltileri iletken olabilir).
Önemli Kovalent Bileşikler:
| Bileşik | Formül | Bağ Türü |
|---|---|---|
| Su | H₂O | Polar |
| Karbondioksit | CO₂ | Apolar |
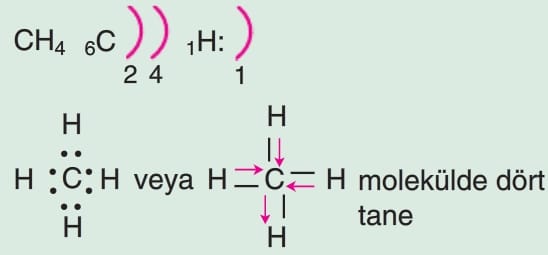
| Metan | CH₄ | Apolar |
| Amonyak | NH₃ | Polar |
| Oksijen | O₂ | Apolar |
Kovalent Bağ vs. İyonik Bağ
| Özellik | Kovalent Bağ | İyonik Bağ |
|---|---|---|
| Atomlar | Ametal + Ametal | Metal + Ametal |
| Elektron Durumu | Ortaklaşa kullanım | Elektron alışverişi |
| Oluşan Yapı | Molekül | Kristal |
| Erime Noktası | Düşük | Yüksek |
| Elektrik İletkenliği | İletmez (katı hâlde) | Suda ve erimiş hâlde iletir |
Çözümlü Örnek Sorular
Soru 1:
Kovalent bağ nedir?
A) Elektron alışverişi ile oluşan bağdır.
B) Elektronların ortaklaşa kullanımıyla oluşan bağdır.
C) Proton alışverişi ile oluşan bağdır.
D) İyonlar arasında oluşan bağdır.
Çözüm:
Kovalent bağ, iki atomun elektronlarını ortaklaşa kullanarak oluşturduğu bir bağ türüdür. Elektron alışverişi yerine, elektronların ortak kullanımı söz konusudur.
Sonuç: B) Elektronların ortaklaşa kullanımıyla oluşan bağdır.
Soru 2:
H₂O molekülünde hangi bağ türü bulunur?
A) İyonik bağ
B) Metalik bağ
C) Kovalent bağ
D) Van der Waals bağları
Çözüm:
H₂O (su) molekülünde oksijen ve hidrojen atomları arasında elektronlar ortaklaşa kullanılarak kovalent bağ oluşturulur.
Sonuç: C) Kovalent bağ
Soru 3:
Aşağıdaki moleküllerden hangisi kovalent bağ içerir?
A) NaCl
B) CO₂
C) MgO
D) KCl
Çözüm:
CO₂ (karbon dioksit) molekülünde karbon ve oksijen atomları arasında kovalent bağlar bulunur. Diğer bileşikler iyonik bağ içerir.
Sonuç: B) CO₂
Soru 4:
HCl molekülünde kaç tane kovalent bağ bulunur?
A) 1
B) 2
C) 3
D) 4
Çözüm:
HCl molekülü, hidrojen ve klor atomları arasında tek bir kovalent bağ içerir.
Sonuç: A) 1
Soru 5:
CH₄ (metan) molekülünde karbon atomu kaç kovalent bağ oluşturur?
A) 1
B) 2
C) 3
D) 4
Çözüm:
CH₄ (metan) molekülünde karbon atomu dört hidrojen atomuyla dört kovalent bağ oluşturur.
Sonuç: D) 4
Notların işime yaricagini düşünüyorum cok güzel bir şekilde aciklamissiniz
Çok iyiydi sagolun
Kimyayı yapamiyorummmmm
çok yardımcı oldu teşekkürler 👍
İyi iyi
cok guzel
Çok yardımcı oldu sağolun