Çözünme Süreci 10. Sınıf Kimya
ÇÖZÜNME SÜRECİ
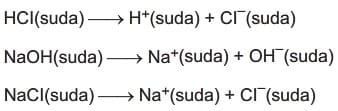
Çözünen moleküllerin veya iyonların, çözücü moleküllerinin veya iyonlarının arasına girmesine çözünme denir.
Bir çözünen bir çözücü içinde moleküllere ayrışarak çözünüyorsa buna moleküler çözünme denir. Şeker, alkol, O2 ve N2 gibi gazlar suda moleküler olarak çözünür.
Moleküler çözünmede suyun elektriksel iletkenliği değişmez. Asit, baz ve tuz gibi maddeler suda iyonlarına ayrışarak çözünür.
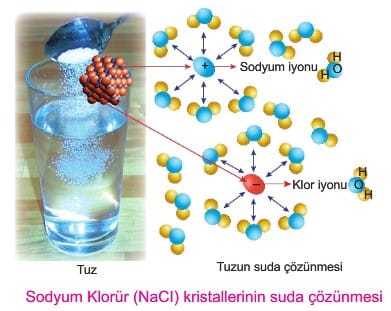
Çözücünün su olması durumunda çözünen taneciklerinin su molekülleri tarafından sarılmasına hidratasyon ya da hidratlaşma denir.
Sıvı – Çözeltilerde Çözücü ve Çözünen Arasındaki Etkileşim
Benzer – benzerini çözer ilkesi gereği polar çözünenler polar çözücülerde, apolar çözünenler de apolar çözücülerde iyi çözünür.
Apolar (kutupsuz) maddeler birbiri içinde çözünürken London etkileşimleri etkilidir. London etkileşimleri; çekirdek etrafındaki elektron yoğunluğunun değişmesinden ortaya çıkar. CCI4‘de I2‘ (İyot)nin çözünmesi sırasında London kuvvetleri etkilidir. H2O ve PH3 gibi polar bileşiklerde etkili olan kuvvetler dipol – dipol etkileşimleridir.
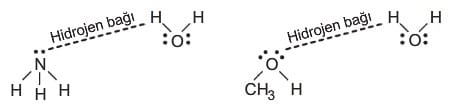
Hidrojen bağları çözünmede en etkili olan fiziksel kuvvetlerdir. Hidrojen bağı; hidrojenin flor (F), oksijen (O) ve azot (N) ile yaptığı bileşiklerde bir bileşiğin H atomu ile diğer bileşiğin elektronegati büyük olan atomu arasında (F, O veya N) görülen çekim kuvvetidir. NH3, HF, CH3OH gibi maddeler suda çözünürken su ile bu moleküller arasında H bağları oluşur.
Apolar bir molekül olan Br2, polar bir bileşik olan H2O(su) da çözünmez.
![]()
Çözücüsü su olan çözeltilere sulu çözeltiler denir. Bir çözelti sulu ise çözünen maddenin yanına parantez içinde (suda), (sulu) ya da (ag) yazılır.
Çözümlü Örnek Test Soruları
Çözünme Süreci
- Bir çözeltide çözünme süreci ne zaman gerçekleşir?
A) Çözücü ve çözünen tamamen karıştığında
B) Çözücü, çözünenin yüzeyinde etkileşim başlattığında
C) Çözücü sıcak olduğunda
D) Çözünen tamamen çözündüğündeÇözüm: Çözünme, çözücü çözünenin yüzeyine etki ederek çözüneni parçalamaya başladığında gerçekleşir. Doğru cevap B‘dir.
- Çözünme hızını artıran faktörlerden biri aşağıdakilerden hangisidir?
A) Sıcaklığı düşürmek
B) Karıştırmak
C) Çözücüyü buharlaştırmak
D) Basıncı düşürmekÇözüm: Çözeltinin karıştırılması çözünme hızını artıran bir faktördür. Doğru cevap B‘dir.
- Çözünme süreciyle ilgili aşağıdaki ifadelerden hangisi doğrudur?
A) Her çözücü her maddeyi çözer.
B) Karıştırmak çözünme hızını düşürür.
C) Sıcaklık artışı çözünme hızını artırabilir.
D) Katı maddeler genellikle gaz çözücülerde çözünür.Çözüm: Sıcaklık artışı genellikle çözünme hızını artırır çünkü moleküller arasındaki hareket hızlanır. Doğru cevap C‘dir.
- Sıcaklığı artırmak aşağıdaki hangi madde için çözünürlüğü artırmaz?
A) Şeker
B) NaCl
C) CO₂
D) ÇayÇözüm: Gazların çözünürlüğü sıcaklık arttıkça azalır, bu nedenle CO₂’nin çözünürlüğü sıcaklık arttığında azalacaktır. Doğru cevap C‘dir.
- Bir katının suda çözünme hızını artırmak için ne yapılabilir?
A) Karıştırmak
B) Sıcaklığı düşürmek
C) Çözünen miktarını artırmak
D) Çözücüyü azaltmakÇözüm: Katı maddelerin çözünme hızını artırmanın yaygın yöntemlerinden biri karıştırmaktır. Doğru cevap A‘dır.
- Çözünme süreci sırasında enerji değişimi hangi faktöre bağlıdır?
A) Çözünenin molekül büyüklüğüne
B) Çözücünün yoğunluğuna
C) Çözücü ve çözünen arasındaki etkileşime
D) Sıcaklığın sabit kalmasınaÇözüm: Çözünme sırasında enerji değişimi çözücü ve çözünen arasındaki etkileşimlere bağlıdır. Doğru cevap C‘dir.
Yardimci oldugunuz için tesekkurler
çok iyi
yardımınız çok dokundu çook teşekkürler