Moleküllerin Lewis Yapısı Polarlık ve Apolarlık 9.Sınıf Kimya
Kovalent bağlı moleküller oluşurken, bağı oluşturan atomların bağ elektronlarına sahip çıkma eğitimlerinin farklı olmasından dolayı molekülde polarlık (kutupluluk) veya apolarlık (kutupsuzluk) meydana gelir. Polarlık ya da apolarlık molekül geometrisini etkileyen kavramlardır. Bağ elektronlarına sahip çıkma eğilimi, atomun bağlayıcı elektron çiftini kendine doğru daha fazla çekme eğilimidir. Periyodik sistemde flor elementine yaklaştıkça elektronlara sahip çıkma eğilimi genellikle artar.
Polar (Kutuplu) Moleküller
Bağ elektronlarına sahip çıkma eğilimi fazla olan ametal atomu bağ elektronlarını daha fazla çekerek kendine yaklaştırır. Elektronların yaklaştığı atom negatif (-), elektronların uzaklaştığı atom ise pozitif (+) yüklenmiş olur. Molekülde kutuplaşma meydana gelir. Kovalent bileşikler, iyonik bileşikler gibi elektron alış verişi sonucu oluşmadığından kovalent bileşiklerdeki kutuplaşmaya kısmi kutuplaşma denir. Kovalent bileşikte kısmı pozitif (δ+) ve kısmı negatif (δ–) yüklenme vardır.
Dikkat: Farklı tür ametal atomları arasında oluşan diatomik (XY), polar kovalent bağlı bileşiklerin molekülleri de polar moleküldür.
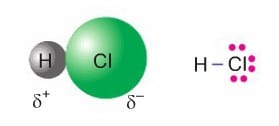
(HCl, HF, NO.. gibi)
HCl kovalent bağ ile oluşmuş bir bileşiktir. Kovalent bağı oluşturan elektron çifti Cl atomu tarafından daha fazla çekilir. Cl atomu δ– yüklenmiş olur. Elektronlar H atomlarından uzaklaştığından H atomu δ+ yüklenmiş olur.
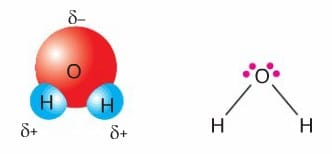
HCl molekülündeki gibi kutuplanmanın meydana geldiği kovalent bileşiklere polar (kutuplu) molekül denir. H2O molekülünde 0 atomunun bağ elektronlarına sahip çıkma eğilimi H’den daha fazladır. H atomları kısmi pozitif (δ+) yüklenir. O atomu kısmi negatif (δ–) yüklenir.
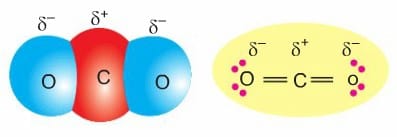
H2O molekülünde H ile O arasında oluşan bağ, polar kovalent bağdır. Fakat H2O bileşiği molekülüne bakıldığında molekül polar (kutuplu) bir moleküldür. CO2 molekülünde O atomları bağ elektronlarını daha fazla çekeceğinde O atomu δ– yüklenirken, elektronlar C atomundan uzaklaştığı için C atomu δ+ yüklenir.
CO2 molekülünde C ile O arasındaki bağ, polar kovalent bağdır. Fakat CO2 bileşiği molekülüne bakıldığında molekül apolar (kutupsuz) bir moleküldür.
Apolar(Kutupsuz) Moleküller
Kovalent bağı oluşturan elektron çifti atomlar tarafından eşit kuvvette çekilirse kutuplanma (polarlanma) olmaz. Örneğin CI2 molekülü kovalent bağ ile oluşmuştur.
Kovalent bağı oluşturan elektron çifti aynı cins atomlar tarafından çekildiğinden elektronlar iki atoma da eşit uzaklıkta yer alır. Kutuplanma meydana gelmez. Cl2 molekülündeki gibi kutuplanmanın meydana gelmediği kovalent bileşiklere apolar(kutupsuz) molekül denilir.