Maddenin Hâlleri ve Isı Alışverişi 8.Sınıf Fen Bilimleri
Maddenin Hâlleri ve Isı Alışverişi
Hâl Değişimi
Maddeler doğada katı, sıvı ve gaz olmak üzere üç hâlde bulunur. Maddenin farklı hâllerinde değişen tek şey molekülleri arasındaki bağların sağlamlığı ve molekül hareketleridir. Maddenin molekül yapısında bir değişme olmaz. Isıtılan veya soğutulan bir madde hâl değiştirebilir. Maddeler ısı alarak veya vererek katı, sıvı ve gaz hâllerine geçebilirler. Maddelerin hâl değişimleri sırasındaki taneciklerin durumu aşağıdaki tabloda verilmiştir.
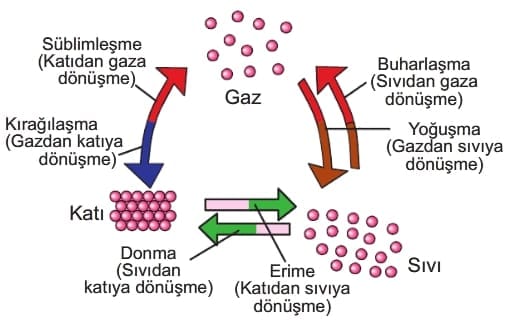
Isıtılan katılar sıvı hâle geçer. Sıvı hâldeki maddeler ise ısıtılınca gaz hâline geçer. Katının direkt olarak gaz hâline dönüşmesi süblimleşme olarak adlandırılır. Bu olayın tam tersi ise kırağılaşmadır.
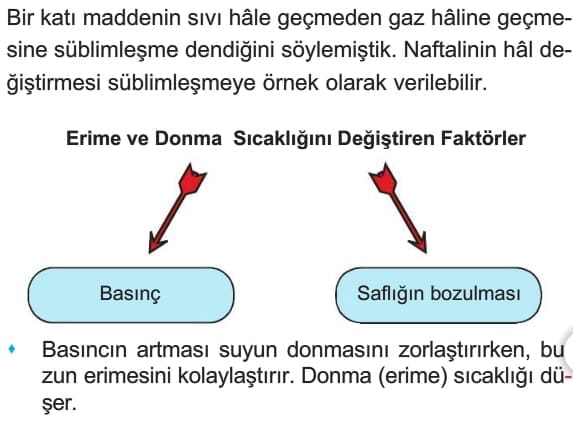
Erime ve Donma
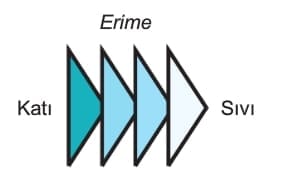
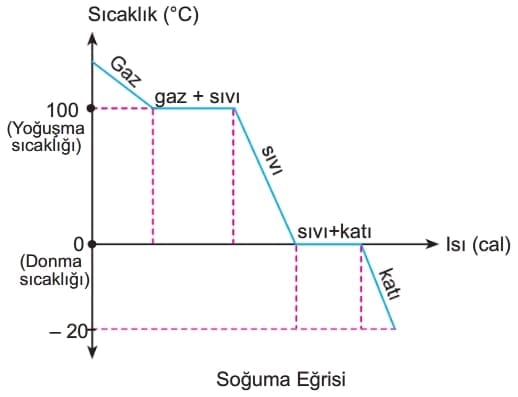
Isıtılan katı madde molekülleri önce hızlanırlar, hareket enerjileri artar. Bu katının sıcaklığının artması anlamına gelir. Isıtma devam ettiğinde madde molekülleri oldukça hızlanarak birbirlerinden uzaklaşır ve aralarındaki bağ gevşer. Böylece sıvılaşma başlar. Bu duruma erime denir. Erimenin başladığı sıcaklığa ise erime sıcaklığı denir. Buzun erime sıcaklığı 0 oC’dir.
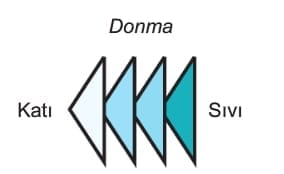
Bu olayın tersi de donma olarak adlandırılır. Sıvı hâldeki maddenin ısı vererek katılaşmaya başladığı sıcaklığa donma sıcaklığı denir. Suyun donma sıcaklığı 0 oC’dir.
Erime ve Donma Özellikleri
- Her maddenin belli basınç altında belirli bir erime ve donma sıcaklığı vardır.
- Bir madde için erime ve donma sıcaklıkları aynıdır.
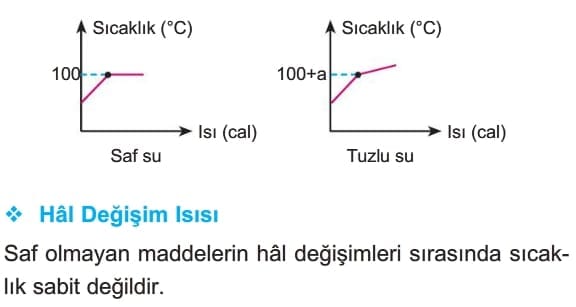
- Saf maddelerde erime veya donma süresince sıcaklık sabit kalır.
Buharlaşma ve Kaynama
Sıvı hâldeki madde ısıtılmaya devam ettirilirse, madde moleküllerinin hızları artar ve sıvının sıcaklığı arttırılmış olur. Bu sırada hızlanan moleküller de aralarındaki bağlar çok kuvvetli olmadığından sıvıyı yüzeyinden terk etmeye başlar. Buna buharlaşma denir.
Madde ısıtılmaya devam ettiriliyorsa buharlaşma hızlanır, sıcaklık belirli bir değere ulaştığında sıvının her tarafında olur ve sıvı kaynamaya başlar.
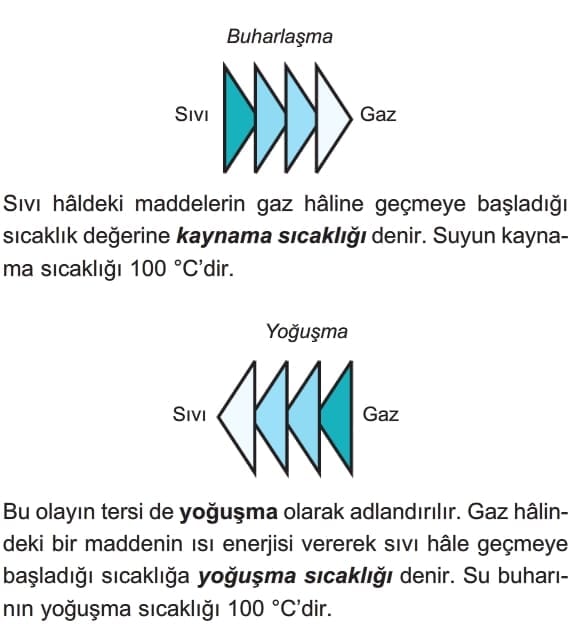
Kaynama ve buharlaşma farklı kavramlardır.
Saf maddelerin kaynama ve yoğuşma sıcaklıkları aynıdır. Bu değer sabit basınç altında değişmez.
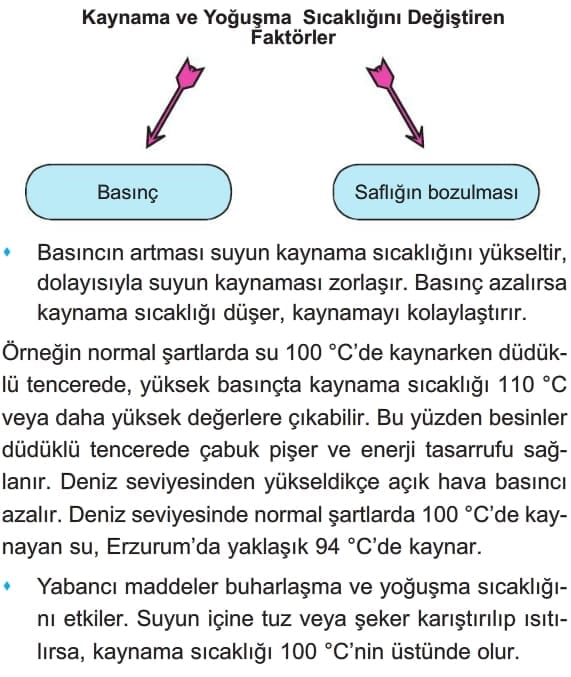
Kaynama ve Yoğuşma
Her maddenin belli basınç altında belirli bir kaynama ve yoğuşma sıcaklığı vardır.
Saf maddelerde kaynama veya yoğuşma süresince sıcaklık sabit kalır.
Çamaşırlarımızın her sıcaklıkta kuruyabilmesi buna örnek gösterilebilir.
Çamaşırların yaz aylarında kışa göre daha hızlı kuruması sıcaklık etkisinden kaynaklanır.
Buharlaşmanın sıvı yüzeyinde olduğunu söylemiştik. Bir tabağa ve şişeye eşit miktarda su koyalım. Oda sıcaklığında bir süre sonra tabakta, şişedekine göre daha fazla suyun buharlaştığını gözleriz. Geniş yüzeyde buharlaşma daha fazla olur.
Yine çamaşırlar (sıcaklık aynı olmasına rağmen) rüzgârlı bir ortamda daha hızlı kurur. Rüzgârlı havada basıncın düşük olması buharlaşmayı hızlandırmıştır.