Çözeltilerin Koligatif Özellikler Kimya Ayt
KOLİGATİF ÖZELLİKLER
Çözeltide çözünen maddenin türüne değil tanecik (iyon veya molekül) derişimine bağlı özelliklere koligatif veya sayısal özellikler denir.
Koligatif Özellikler;
1. Buhar basıncı düşmesi
2. Kaynama noktası yükselmesi
3. Donma noktası alçalması
4. Ozmotik basınç
olarak sıralanabilir.
1. Buhar Basıncı Düşmesi
A) Uçucu olmayan bir madde (genellikle katı) bir çözücüde çözündüğünde oluşan çözeltideki çözücünün buhar basıncı saf çözücünün buhar basıncından daha düşüktür.
B) Uçucu sıvılar birbirinde çözünürse, her iki sıvının buhar basıncı saf çözücülerine göre bir miktar düşer. Çözeltinin buhar basıncı her iki bileşenin buhar basınçları toplamıdır.
2. Kaynama Noktası Yükselmesi
Sıvılar, buhar basınçları dış (atmosfer) basınca eşit olduğunda kaynamaya başlarlar. Saf maddelerde kaynama süresince sıcaklık değişmez. Çünkü harcanan enerji moleküller arası bağların kırılması için kullanılır. Yani kaynama süresince sıvının potansiyel enerjisi artarken ortalama kinetik enerjisi değişmediğinden sıcaklık artmaz.
Sıvıların kaynamaya başladığı sıcaklığa kaynama noktası denir. Saf su 1 atm dış basınçta 100 oC’de kaynarken, etanol 78 oC’de kaynar. Kaynama noktası moleküller arası çekim kuvvetleriyle doğrudan ilgilidir. Suyun daha yüksek sıcaklıkta kaynaması moleküller arası çekim kuvvetlerinin etanole göre daha güçlü olmasındandır.
Bir sıvıda uçucu olmayan bir katı çözündüğünde çözücü ve çözünen molekülleri arasındaki etkileşimler çözücünün buharlaşmasını zorlaştırır. Düşen buhar basıncının atmosfer basıncına eşitlenmesi ancak daha yüksek bir sıcaklıkta gerçekleşir, yani kaynama noktası yükselir.
Kaynama noktasındaki yükselmenin miktarı çözünen maddenin tanecik sayısına yani mol sayısına bağlıdır. Çözünen maddenin türüne bağlı değildir.
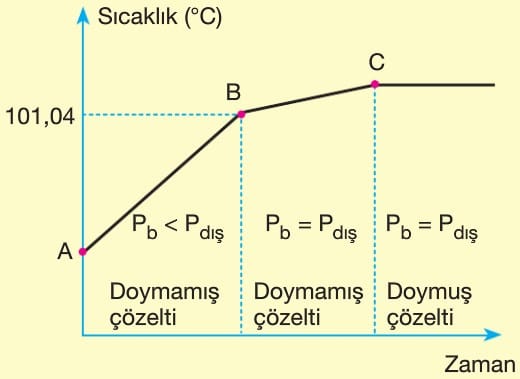
A – B Noktaları Arası
Doymamış çözeltinin sıcaklığı ve buna bağlı olarak buhar basıncı (Pb) artar. B noktasında (101,04 °C) buhar basıncı dış basınca eşitlendiğinden kaynama başlar.
B – C Noktaları Arası
Kaynayan çözeltide yoğun buharlaşmadan dolayı tuz derişimi artar ve buharlaşma zorlaşır. Dış basınca eşit buhar basıncı sağlanarak kaynamanın devam edebilmesi için sıcaklık artar.
C Noktasından Sonra
Çözelti doymuştur. Isındıkça tuzun fazlası çöker ve derişim sabit kalır. Sabit derişimde kaynama sıcaklığı da sabit kalır.
Donma Noktası Alçalması
Kaynama noktası yükselmesi için çözücüde uçucu olmayan bir maddenin çözünmesi gerekir. Donma noktası alçalmasının gerçekleşmesi için bir sıvıda uçucu olan veya olmayan bir maddenin çözünmesi yeterlidir.
içinde herhangi bir madde çözünen çözeltinin donma noktası saf çözücüsünden daha düşüktür.
Saf bir sıvı soğutulduğunda sıvı moleküllerinin kinetik enerjisi azalır ve moleküller birbirine yaklaşırlar. Donma sırasında moleküller arası çekim kuvveti moleküllerin kinetik enerjisinin üstesinden gelir ve sıvı dışarı ısı vererek katılaşır.
Sıvı → Katı + ısı
Çözeltilerde, çözünen tanecikler, çözücü sıvının moleküllerinin birbirine yaklaşarak katılaşmasını zorlaştırır. Ancak çözeltiden daha fazla ısı kaybedilirse, çözücü molekülleri birbirine yaklaşabilir. Bu nedenle, çözeltinin donması için saf çözücüsüne göre daha fazla soğutulması gerekir.
Donma noktası alçalması, çözünenin tanecik derişimine bağlıdır.
1 kg suda 1 mol tanecik çözünmesiyle elde edilen çözeltinin donmaya başlama sıcaklığı –1,86 °C olarak ölçülmüştür.
Donma Noktasındaki Alçalma Hesaplaması
Donma noktasındaki alçalma aşağıdaki formülle hesaplanır:
ΔTd = -Kd × m × i
ΔTd = Donma noktasindaki alcalma
Kd = Donma noktasi alcalmasi (kriyoskopi) sabiti
m = Çözeltinin molalitesi
i = Van’t Hoff faktörü (tanecik sayisini ifade eder)
Not: Orijinal metinde “t·s” olarak görünen ifade, kimyada yaygin olarak “i” (Van’t Hoff faktörü) ile gösterilmektedir. Bu, çözünen maddenin iyonlasma/ayrisma derecesini ve dolayisiyla çözeltideki toplam tanecik sayisini temsil eder.
Ebülyoskopi ve Kriyoskopi
Ebülyoskopi: Bir çözeltideki kaynama noktası yükselmesinin ölçülerek çözünen maddenin mol kütlesinin deneysel olarak hesaplanması yöntemidir.
Kriyoskopi: Donma noktasındaki alçalmanın ölçülerek çözünen maddenin mol kütlesinin hesaplanması yöntemidir.
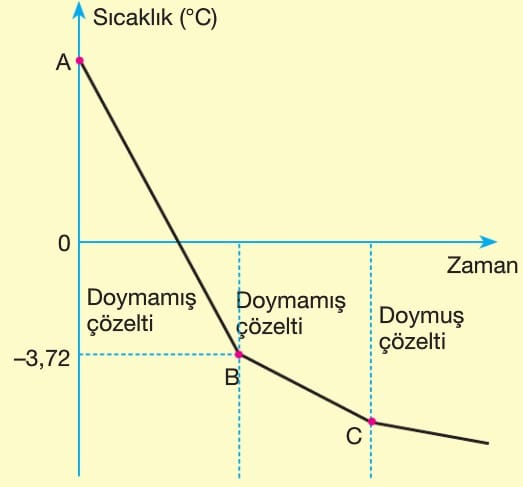
A – B Noktaları Arası
Doymamış çözeltinin sıcaklığı düşer. Donma başlamaz.
B – C Noktaları Arası
B noktasında (-3,72 °C) doymamış çözelti donmaya başlar. Donma sırasında çözücü miktarı azaldığından çözünen derişimi artar. Derişim arttıkça çözücü moleküllerinin birbirine yaklaşması daha da zorlaşır. Donma olayının devamı için sıcaklık azalır.
C Noktasından Sonra
Çözelti doymuş olarak soğumaya devam eder. Kaynamadan farklı olarak derişim artmaya devam eder. Çünkü çözeltiden donarak çözücü ayrılırken çözelti derişimi artar. Bu yüzden sıcaklık azalmaya devam eder.
Not:
- Donma olayında çözücü kristalleşerek ayrılırken, çözünen madde çözeltide kalır ve derişim sürekli artar.
- Bu durum, kaynama sürecindeki sabit derişim davranışından farklıdır.
- Grafikte sıcaklık-zaman eğrisi, donma sırasında sürekli düşüş gösterir (kaynama sırasında ise sabit kalır).
Ozmotik Basınç
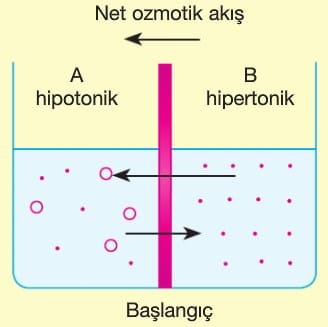
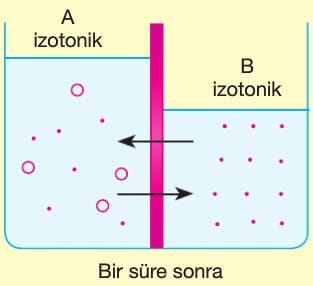
Derişimleri farklı, yarı geçirgen zar ile birbirinden ayrılmış iki çözeltiden seyreltik olandan derişik olana doğru çözücü geçişine ozmos olayı denir. Yarı geçirgen zarın bir tarafında saf su diğer tarafında bir çözelti bulunduğunda da ozmos gerçekleşir.
Ozmoz Olayı
. : Çözücü molekülleri (H₂O)
o : Çözünen molekülleri (C₁₂H₂₂O₁₁)
Su ve Şekerli Su Arasında Ozmoz:
- Çözünen molekülleri (şeker) zardan geçemez.
- Çözücü su molekülleri her iki yönde zardan geçer, ancak derişim farkı nedeniyle B bölmesinden (seyreltik) A bölmesine (derişik) net su geçişi olur.
- Ozmoz, A bölmesinde oluşan hidrostatik basınç su geçişini dengeleyene kadar sürer.
- Bu denge basıncına ozmotik basınç denir.
-
- Tanım: Derişik çözeltinin seyreltik çözeltiden su emme kuvvetidir.
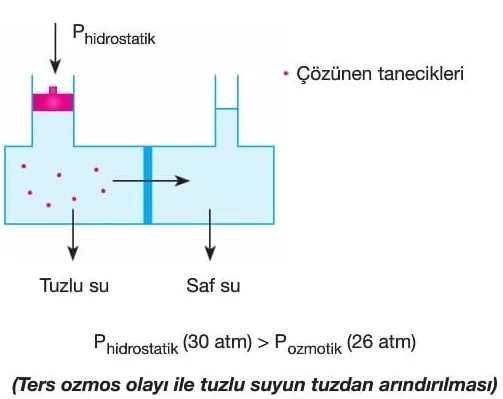
Ters Ozmoz
- Tanım: Ozmotik basıncın üzerinde bir basınç uygulayarak, su moleküllerinin derişik çözeltiden saf su tarafına ters yönde geçişini sağlama işlemidir.
- Uygulama Örneği:
- Deniz suyundan tuzun arındırılmasında kullanılır.
- Deniz suyunun ozmotik basıncı ≈ 26 atm‘dir.
- 30 atm gibi daha yüksek basınç uygulanarak saf su elde edilir.
Özet:
- Normal Ozmoz: Suyun seyreltikten derişiğe geçişi (doğal süreç).
- Ters Ozmoz: Enerji harcanarak suyun derişikten saf tarafa zorla geçirilmesi (endüstriyel uygulama).
Çözümlü Örnek Sorular
1. Donma Noktası Alçalması
Soru:
1 kg suda 0,5 mol şeker (C₁₂H₂₂O₁₁) çözülerek hazırlanan çözeltinin donma noktası kaç °C’dir? (Kd: 1,86 °C·kg/mol)
Çözüm:
- ΔTd = -Kd × m × i
- Şeker iyonlaşmadığı için i = 1
- m = 0,5 mol/kg
- ΔTd = -1,86 × 0,5 × 1 = -0,93 °C
- Saf su 0 °C’de donduğundan:
Donma noktası = 0 – 0,93 = -0,93 °C
2. Kaynama Noktası Yükselmesi
Soru:
2 kg suda 1 mol NaCl çözülerek hazırlanan çözeltinin kaynama noktası kaç °C’dir? (Kk: 0,52 °C·kg/mol, NaCl tamamen iyonlaşır)
Çözüm:
- ΔTk = Kk × m × i
- NaCl → Na⁺ + Cl⁻ (i = 2)
- m = 1 mol / 2 kg = 0,5 molal
- ΔTk = 0,52 × 0,5 × 2 = 0,52 °C
- Saf su 100 °C’de kaynadığından:
Kaynama noktası = 100 + 0,52 = 100,52 °C
3. Ozmotik Basınç
Soru:
0,1 M 500 mL şeker (C₁₂H₂₂O₁₁) çözeltisinin 25 °C’deki ozmotik basıncı kaç atm’dir? (R: 0,082 L·atm/mol·K)
Çözüm:
- π = M × R × T × i
- Şeker iyonlaşmaz (i = 1)
- T = 25 + 273 = 298 K
- π = 0,1 × 0,082 × 298 × 1 = 2,44 atm
4. Buhar Basıncı Alçalması
Soru:
27 °C’de 1 mol glikoz (C₆H₁₂O₆) ve 9 mol su içeren çözeltinin buhar basıncı kaç mmHg’dir? (Saf suyun buhar basıncı: 26,7 mmHg)
Çözüm:
- Raoult Yasası: Pçözelti = Xçözücü × P°çözücü
- Xsu = 9 / (9 + 1) = 0,9
- Pçözelti = 0,9 × 26,7 = 24,03 mmHg
5. Tanecik Sayısı ve Koligatif Özellik
Soru:
Aynı sıcaklıkta eşit hacimde hazırlanan 0,1 M şeker (C₁₂H₂₂O₁₁) ve 0,1 M CaCl₂ çözeltilerinin ozmotik basınçları arasındaki ilişki nedir?
Çözüm:
- Şeker: i = 1 → π = 0,1 × R × T × 1
- CaCl₂ → Ca²⁺ + 2Cl⁻ (i = 3) → π = 0,1 × R × T × 3
- CaCl₂ çözeltisinin ozmotik basıncı şekerinkinin 3 katıdır.
Anahtar Bilgiler:
- i (Van’t Hoff faktörü): İyonlaşan maddelerde tanecik sayısını belirtir (Örn: NaCl için i=2, CaCl₂ için i=3).
- Koligatif özellikler: Yalnızca çözünen tanecik sayısına bağlıdır, türüne değil!
- Sıralama (aynı molalite için): Ozmotik basınç > Kaynama noktası yükselmesi > Donma noktası alçalması.
Not: Soruları çözerken birimlere (molalite vs. molarite) ve iyonlaşma durumuna dikkat edin!