Amorf ve Kristal Katılar 9. Sınıf Kimya
Katı maddeler, atomların ve moleküllerin düzenlenme şekillerine göre farklı yapılar gösterirler. Amorf katılar ve kristal katılar, bu yapıların iki temel türüdür. Kristal katılar, düzenli ve tekrarlayan bir yapı oluştururken, amorf katılar düzensiz ve belirli bir düzenin olmadığı yapılar oluşturur. Katı maddelerin fiziksel özellikleri, bu yapısal farklara göre değişiklik gösterir.
Amorf Katılar
Katıyı oluşturan tanecikler gelişigüzel istiflenmiştir.
Belirli bir kristal yapıları yoktur. Belirli bir sıcaklık aralığında yumuşayarak akıcılık kazanırlar. Yumuşamanın başladığı bu sıcaklığa camsı geçiş sıcaklığı denir. Cam, plastik, tereyağı, mum, parafin ve ruj örnek olarak verilebilir.
Kristal Katılar
Taneciklerin belirli bir geometrik şekle göre dizilmesiyle oluşan kararlı maddelerdir. Belirli kristal yapıları vardır. Katıyı bir arada tutan kuvvetlere göre sınıflandırılırlar.
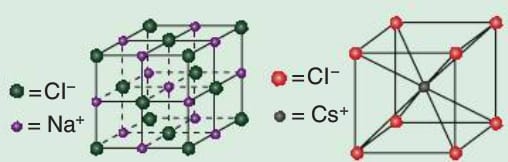
İyonik Katılar
Anyon ve katyonlar arasındaki güçlü elektrostatik çekim kuvvetleriyle oluşur.
Bu katıları oluşturan en küçük birime birim hücre denir. (Molekül değil.)
Sert ve kırılgandırlar. Erime ve kaynama noktaları yüksektir. Katı hâlde elektriği iletmezler. Sıvı hâlleri ve sulu çözeltileri elektriği iletir.
Genellikle katyon, anyonların arasına yerleşir. NaCl, CsCI, ZnS, CaO, CaF2, KNO3 kristal katılara örnek verilebilir.
Kovalent Katılar
Çok sayıda ametal ve/veya yarı metal atomunun elektronlarını ortaklaşa kullanmasıyla oluşan katılardır.
Belirli bir ağ yapıları vardır.
Elmas (C), grafit, silisyum nitrür (Si3N4), kuartiz (SiO2), silisyum karbür (SiC) örnek olarak verilebilir.
Elmasta her bir C atomuna 4 tane C atomunun bağlı olduğu bir ağ yapısı olduğundan en sert doğal maddedir. Aynı zamanda bu yapı erime ve kaynama noktasının çok yüksek olmasını sağlar ve kesici olarak kullanılır.
Grafit ise daha yumuşaktır ve elektriği iletir.

Moleküler Katılar
Maddeyi oluşturan tanecikler arasında genellikle hidrojen bağı, dipol-dipol ve London etkileşimleri bulunur. Erime ve kaynama noktaları genellikle düşüktür. Elektrik akımını genellikle iletmezler. Katı hâldeki SO2, C4Hıo, İ2, S8, CO2(k) (Kuru buz), C6Hı2O6, H2O gibi maddelerde bulunur.
Metalik Katılar
Metal katyonlarının elektron denizi içinde düzenli bir şekilde yerleşmesiyle oluşur.
Metallerdeki serbest elektronlardan dolayı metaller;
* tel ve levha hâline getirilebilme,
* elektriği ve ısıyı iletme,
* yüzeylerinin parlak olması,
* erime ve kaynama noktalarının yüksek olması
gibi özellikler kazanırlar.
Zn, Ca, Na, Fe, Cu, Au örnek verilebilir.
Çözümlü Örnek Sorular
Soru 1
Aşağıdakilerden hangisi kristal katılara bir örnektir?
A) Cam
B) Şeker
C) Plastik
D) Lastik
Çözüm:
Kristal katılar düzenli ve periyodik bir yapıya sahiptir. Şeker, düzenli bir kristal yapıya sahiptir, bu nedenle doğru cevaptır.
Doğru cevap: B
Soru 2
Amorf katılar için aşağıdaki ifadelerden hangisi doğrudur?
A) Belli bir erime noktaları vardır
B) Molekülleri düzensiz bir şekilde dizilmiştir
C) Düzenli ve periyodik bir yapıya sahiptirler
D) Bileşenleri belirli bir geometrik şekil oluşturur
Çözüm:
Amorf katılar, düzensiz bir moleküler yapıya sahiptir ve belirli bir erime noktaları yoktur.
Doğru cevap: B
Soru 3
Kristal katılarla ilgili olarak aşağıdakilerden hangisi yanlıştır?
A) Düzenli bir iç yapıya sahiptirler
B) Belirli bir erime sıcaklıkları vardır
C) Belirli bir şekilleri yoktur
D) Sert ve kırılgandırlar
Çözüm:
Kristal katılar düzenli bir iç yapıya ve belirli bir şekle sahiptirler. Belirli erime sıcaklıkları da bulunur. Ancak, belirli bir şekilleri yoktur ifadesi yanlıştır.
Doğru cevap: C
Soru 4
Aşağıdaki maddelerden hangisi amorf katıdır?
A) Buz
B) Elmas
C) Cam
D) Tuz
Çözüm:
Cam, düzensiz yapıya sahip olduğu için amorf katı bir maddedir. Diğer maddeler kristal yapıdadır.
Doğru cevap: C
Soru 5
Kristal katıların sert ve kırılgan olmasının nedeni nedir?
A) Düzensiz moleküler yapıları
B) Moleküller arasındaki zayıf bağlar
C) Düzenli ve sıkı moleküler yapıları
D) Yüksek viskoziteleri
Çözüm:
Kristal katıların düzenli ve sıkı moleküler yapısı onları sert ve kırılgan hale getirir.
Doğru cevap: C

Maddenin Katı Hali: Belli bir şekli olan ve bu şeklin ortamlara göre değişmediği hale katı hal denir. Katı maddenin kaşık, masa ve bardak gibi şekil almış olanlarına cisim adı verilir.
Katı haldeki maddenin tanecikleri birbiri ile temas halindedir. Katı hal maddenin en yoğun halidir. Katılarda tanecikler, hemen hemen hiçbir serbest hareket yapmadan, belirli bir konu