Kimyasal Bağlar 8.Sınıf Fen
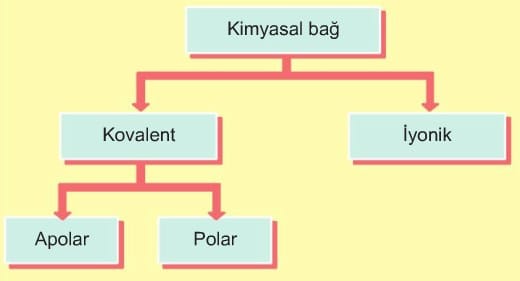
Çevremizde gördüğümüz maddelerin çeşitliliği çok sayıda atomun değişik şekillerde bağlanmasından kaynaklanmaktadır. Atomları ve iyonları bir arada tutan kuvvetlere kimyasal bağ denir. Kimyasal bağlar aynı tür ya da farklı tür atomlar arasında oluşabilir. Çekirdekle elektronlar arasındaki uzaklık, elektronların enerjisinin bir ölçüsüdür. Yüksek enerjili elektronlar, düşük enerjili elektronlara göre çekirdekten daha uzakta bulunur. Elektronların çekirdek çevresinde bulunabildikleri belirli bölgelere enerji düzeyi denir. Her enerji düzeyinde belirli sayıda elektron bulunur, Yüksüz bir atomun en dış enerji düzeyinde 8 elektron bulunuyorsa (2He hariç) atom kararlı yapıya sahiptir.
Periyodik cetvelin 8A grubundaki soy gaz adı verilen atomlar şanslıdır. Çünkü soy gaz atomlarının son enerji katmanlarında helyumda 2, diğerlerinde 8 er elektron bulunur. Soy gazlar bu özellikleri nedeniyle kararlı yapıya sahiptirler. Soy gazların bağ yapma eğilimleri olmadığından doğada tek atomlu hâlde (helyum, neon, argon… gibi) bulunurlar. Soy gazların dışındaki atomlar kararlı hale ulaşma eğilimlerinden dolayı en son enerji düzeyindeki elektron sayılarını 2 veya 8’e tamamlamak için ya elektron alışverişi yaparlar ya da elektronlarını ortaklaşa kullanırlar.
Bir atomun en yüksek enerji düzeyinde bulunan ve kolay koparılan elektronlarına değerlik elektronları denir. Kimyasal bağ oluşumunda, bağ oluşumuna katılan atomların son enerji düzeyindeki elektronları etkilidir. Atomların değerlik elektron sayılarını 2’ye tamamlamalarına dublet, 8’e tamamlamalarına oktet kuralı denir.
Son enerji seviyesinde 1, 2 ve 3 elektron bulunduran atomlar soy gaz elektron düzenine ulaşmak için elektron vererek (+) yüklü iyon oluşturma eğilimi gösterirler. Bu atomlar genelde metaldir (1H, 2He, 5B hariç).
Son enerji seviyesinde 5, 6, ve 7 elektron bulunduran atomlar soy gaz elektron düzenine ulaşmak için elektron alarak (-) yüklü iyon oluşturma eğilimi gösterirler. Bu atomlar genelde ametaldir. (1H, bu kurala uymayan ametaldir.)
Atomların metal ya da ametal olmasına göre oluşan bağın türü değişir.
1) İyonik Bağ
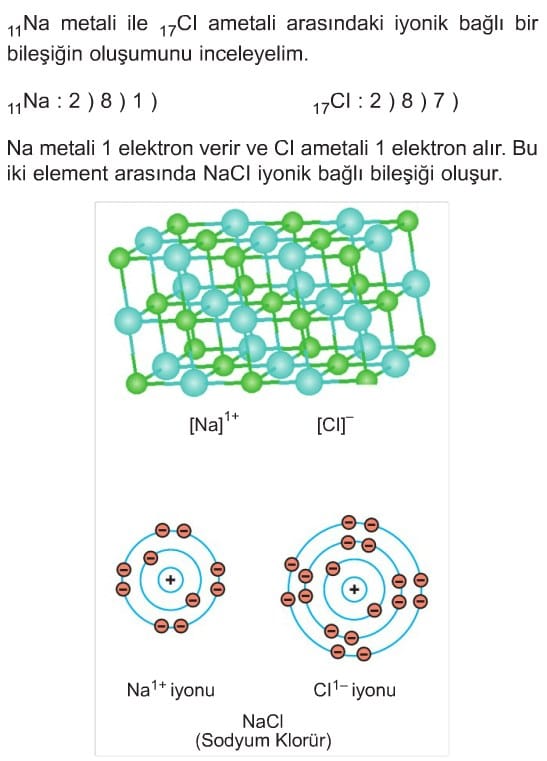
Metaller ile ametaller arasında bileşik oluştuğunda metal elektron verir, ametal ise metalin verdiği elektronları alır. Bu şekilde elektron alış verişi ile oluşan bağlara iyonik bağ denir. Metaller genellikle son temel enerji seviyelerindeki elektron sayısını aynı periyottaki soy gaza benzetir.
İyonik Bağlı Bileşiklerin Özellikleri
- Bileşikte anyon ve katyon vardır.
- Alınan toplam elektron sayısı, verilen toplam elektron sayısına eşittir.
- İyonik bileşikler katıdır. Kristalli yapıdadırlar.
- Katı hâlde elektrik akımını iletmezler.
- Sıvı hâlleri ya da sulu çözeltileri elektrik akımını iletir.
2) Kovalent Bağ
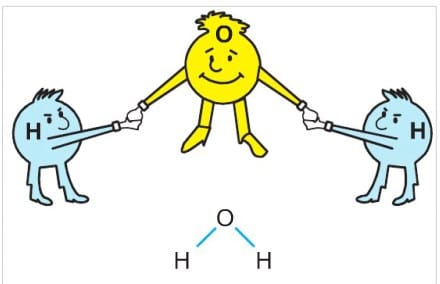
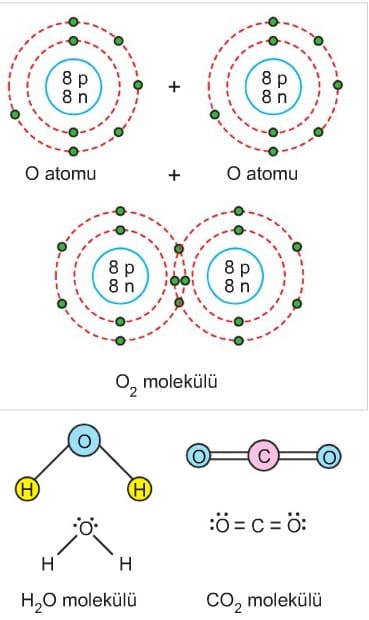
Ametal – ametal atomları arasında elektron alışverişi söz konusu olamaz. Bu tür atomlar kararlı yapıya ulaşabilmek için en dış enerji düzeyindeki elektronlardan bazılarını ortaklaşa kullanırlar. Atomlar arasında elektronların ortaklaşa kullanılması sonucu oluşan kimyasal bağa kovalent bağ denir.
Atomlar arasındaki bir çift elektronun ortaklaşa kullanılması sonucunda tekli (CI — CI), iki çift elektronun ortak kullanılmasıyla ikili (O = O), üç çift elektronun ortak kullanılmasıyla üçlü (N ≡ N) kovalent bağ oluşur.
Aynı ya da farklı tür atomların kovalent bağlarla oluşturduğu en küçük birime molekül denir. Örneğin; H2, NH3, F2 gibi. Bir molekülü oluşturan elementlerin atom sayıları belirlidir. Örneğin; suyun (H2O) bir molekülünde 2 hidrojen (H) ve 1 oksijen (O) atomu bulunur.