İyon-Dipol Etkileşimi 9. Sınıf Kimya
Kimyasal etkileşimler, moleküller ve iyonlar arasındaki kuvvetlerin maddelerin özelliklerini belirlemesinde önemli bir rol oynar. İyon-dipol etkileşimi, bir iyon ile polar bir molekül arasındaki elektrostatik çekim kuvvetidir. Bu etkileşim, çözeltilerin oluşumunda, özellikle iyonik bileşiklerin su gibi polar çözücülerde çözünmesinde büyük bir etkiye sahiptir.
İyon-Dipol Etkileşimi
İyonlar ile polar moleküller arasında görülür.
Nacı, KBr ve LiCI gibi iyonik bağlı bileşiklerin suda çözünmesiyle oluşur…
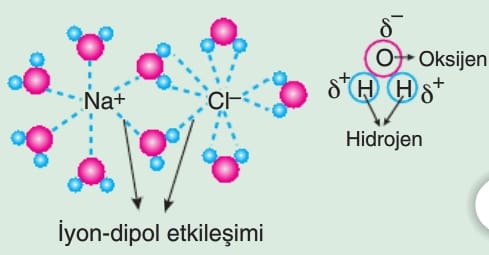
Su, saf hâldeyken sadece hidrojen bağları içerir ve suyun kaynama noktası 100o dir. Saf suda tuz çözünürse fazladan iyon-dipol bağları oluşur, bu durum kaynama noktasını yükseltir. 1 kg suda 351 g Naci çözünürse kaynamaya başlama sıcaklığı 106,24 oC olur.
Çözümlü Örnek Sorular
Soru 1
İyon-dipol etkileşimi hangi iki tür parçacık arasında oluşur?
A) İki iyon
B) İki polar molekül
C) Bir iyon ve bir polar molekül
D) İyonik ve kovalent bağlar arasında
Çözüm:
İyon-dipol etkileşimi, bir iyon ile polar bir molekül arasında meydana gelir. Bu etkileşim, polar molekülün dipol yapısıyla iyon arasında çekim kuvvetleri oluşturur.
Doğru cevap: C
Soru 2
Aşağıdaki örneklerden hangisi iyon-dipol etkileşimine örnek olarak verilebilir?
A) NaCl’in su içinde çözünmesi
B) CO2’nin su içinde çözünmesi
C) O2’nin havada bulunması
D) N2 ve H2’nin bir arada bulunması
Çözüm:
NaCl gibi iyonik bileşikler suya konulduğunda, su molekülleri polar yapısıyla Na+ ve Cl− iyonları ile etkileşime girer. Bu durum iyon-dipol etkileşimine örnektir.
Doğru cevap: A
Soru 3
İyon-dipol etkileşiminin kuvveti hangi faktörlerden etkilenir?
A) İyonun yükü ve polar molekülün dipol momenti
B) Molekül büyüklüğü
C) Moleküller arası mesafe
D) Yukarıdakilerin hepsi
Çözüm:
İyon-dipol etkileşiminin kuvveti, iyonun yükü, polar molekülün dipol momenti ve moleküller arası mesafe gibi faktörlerden etkilenir.
Doğru cevap: D
Soru 4
İyon-dipol etkileşimlerinin en güçlü olduğu durum aşağıdakilerden hangisidir?
A) İyon yükünün küçük olduğu durumlarda
B) Moleküller arası mesafenin büyük olduğu durumlarda
C) Dipol momentinin yüksek olduğu moleküller arasında
D) Apolar moleküller arasında
Çözüm:
İyon-dipol etkileşimi, polar molekülün dipol momenti ne kadar büyükse ve iyonun yükü ne kadar yüksekse o kadar güçlü olur.
Doğru cevap: C
Soru 5
İyon-dipol etkileşimlerinin gerçekleştiği bir çözeltide ne gözlemlenir?
A) Çözücü moleküller iyonları sarar
B) İyonlar çözücü moleküllerden uzaklaşır
C) Çözücü moleküller buharlaşır
D) İyonlar birbirine yaklaşır
Çözüm:
İyon-dipol etkileşimleri sonucunda çözücü moleküller iyonları sararak hidratasyon veya solvasyon kabukları oluşturur.
Doğru cevap: A