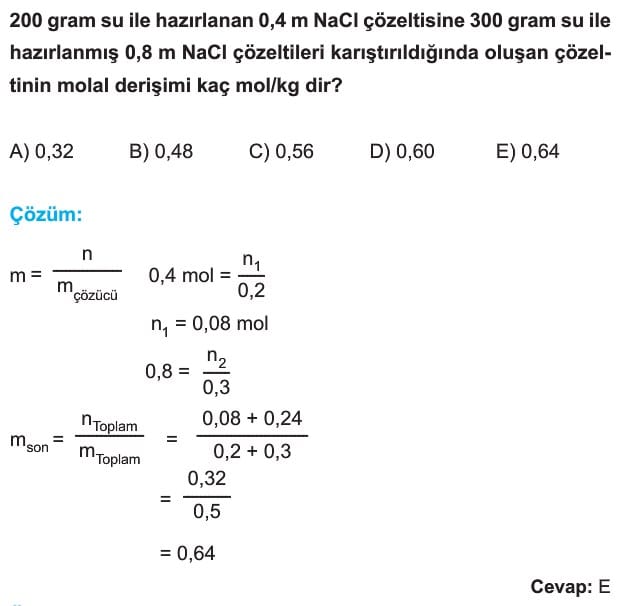
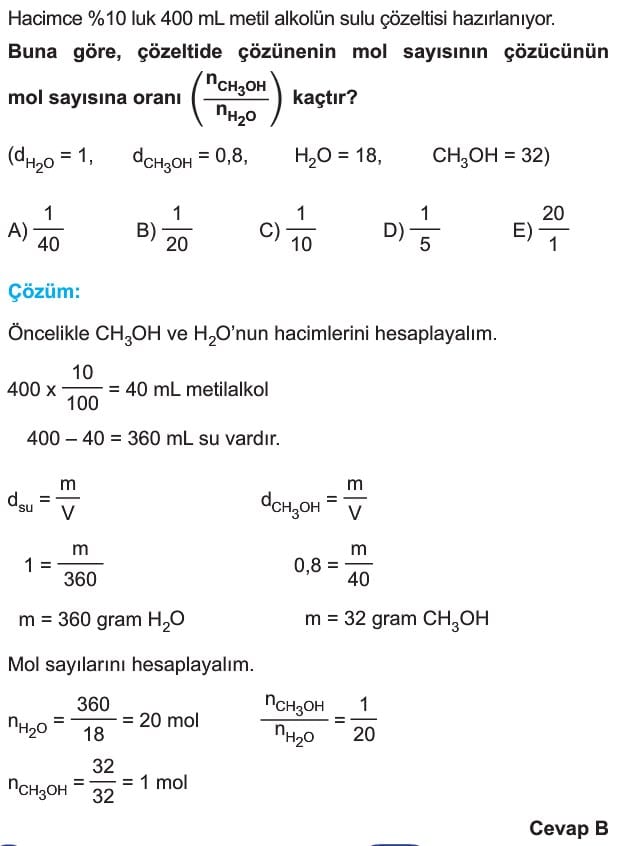
Derişim Birimleri 11. Sınıf Kimya
Derişim
Çözeltideki çözünen madde miktarının çözeltiye oranına derişim denir.
Kullanım amacına göre farklı türde derişimlerden bahsedebiliriz.
Kütlece Derişim
Çözünen maddenin kütlesinin çözelti kütlesine oranına denir.
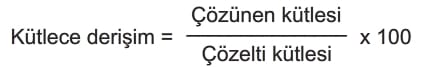
ppm ve ppb Derişimi
ppm: 106 gram suda çözünen madde miktarını gram cinsinden ifadesidir.
ppb: 109 gram suda çözünen madde miktarın gram cinsinden ifadesidir.
Molarite
1 litre çözeltide çözünen maddenin mol sayısına molarite denir.
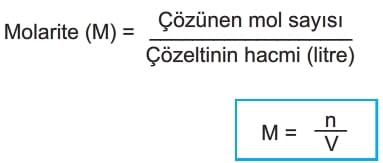


Çözeltilerin Karıştırılması ile İyon Derişimi
İki çözelti karıştırıldığında dikkat edilecek durum hangi maddenin veya iyonun derişimi isteniyorsa o maddenin toplam mol sayısı ve çözelti hacmidir.

Molalite
1000 g (1 kg) suda çözünen maddenin mol sayısına molalite denir.

Sorular:
Kütlece %20 lik 200 g ve kütlece %30 luk 400 g şekerli su çözeltileri karıştırılıyor. Elde edilen karışıma 140 g şeker ve 260 g su ekleniyor.
Oluşan son karışımda çökelti olmadığına göre, elde edilen son karışım kütlece yüzde kaçlıktır?
A) 20 B) 25 C) 30 D) 35 E) 50
600 ml saf suda 200 ml saf etil alkol çözünerek bir karışım hazırlanıyor.
Oluşan çözeltide hacim korunduğuna göre, etil alkolün hacimce yüzdesi kaçtır?
A) 25 B) 45 C) 55 D) 65 E) 75
Derişim Birimleri Soruları ve Çözümleri
Çözümlü Örnek Test Soruları
Derişim Birimleri
Bir çözeltide çözünen maddenin miktarını ifade etmek için çeşitli derişim birimleri kullanılır. Bu birimler, çözelti hazırlarken veya reaksiyonların hesaplamalarını yaparken önemli rol oynar.
1. 1 litre çözelti içerisinde 5 mol çözünen madde varsa, bu çözeltinin molaritesi (M) nedir?
A) 5 M
B) 0,5 M
C) 10 M
D) 1 M
Çözüm: Molarite (M), bir litre çözelti içindeki mol sayısıdır. Burada 5 mol çözünen olduğuna göre çözeltinin molaritesi 5 M’dir. Cevap A.
2. 500 mL suda 0,25 mol NaCl çözünmüştür. Bu çözeltinin molaritesi nedir?
A) 0,5 M
B) 1 M
C) 2 M
D) 0,25 M
Çözüm: Molariteyi bulmak için mol sayısı litre hacme bölünür. 500 mL = 0,5 L olduğundan 0,25 mol / 0,5 L = 0,5 M’dir. Cevap A.
3. 1,5 mol NaOH içeren 3 litrelik bir çözeltinin molaritesi nedir?
A) 0,5 M
B) 1 M
C) 1,5 M
D) 2 M
Çözüm: Molarite, çözünenin mol sayısının çözeltinin litre cinsinden hacmine bölünmesiyle bulunur. 1,5 mol / 3 L = 0,5 M’dir. Cevap A.
4. Aşağıdakilerden hangisi, çözeltinin molaritesini (M) etkileyen faktörlerden biri değildir?
A) Çözünen madde miktarı
B) Çözeltinin hacmi
C) Çözücünün türü
D) Çözünenin mol sayısı
Çözüm: Çözeltinin molaritesi, çözünenin mol sayısı ve çözeltinin hacmiyle hesaplanır. Çözücünün türü molariteyi etkilemez. Cevap C.
5. %5’lik (m/v) bir çözeltide, 100 mL çözelti içinde kaç gram çözünen madde vardır?
A) 0,5 g
B) 5 g
C) 10 g
D) 50 g
Çözüm: %5 (m/v) çözeltide, her 100 mL çözelti içinde 5 g çözünen madde bulunur. Cevap B.
6. Aşağıdakilerden hangisi derişim birimleri arasında yer almaz?
A) Molarite
B) Molalite
C) Mol fraksiyonu
D) Yoğunluk
Çözüm: Yoğunluk, bir derişim birimi değildir. Cevap D.