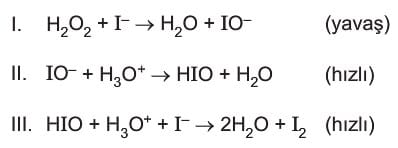Tepkime Hızları 11. sınıf kimya
Konunun sonunda ders videoları yer almaktadır.
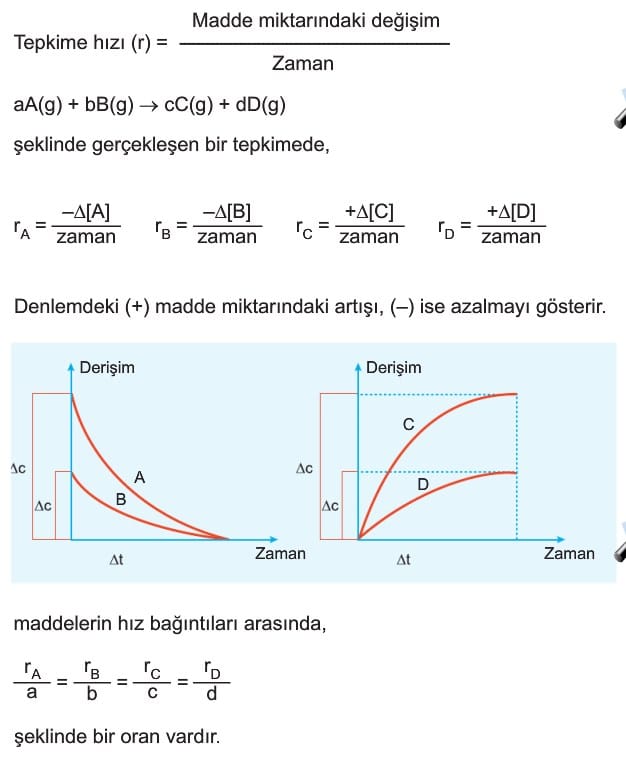
Kimyasal tepkimelerde hız birim zamanda harcanan veya oluşan madde miktarı olarak tanımlanır. Kimyasal tepkimelerde hız ifade edilirken madde miktarındaki değişim genelde mol veya molarite ile ifade edilir.
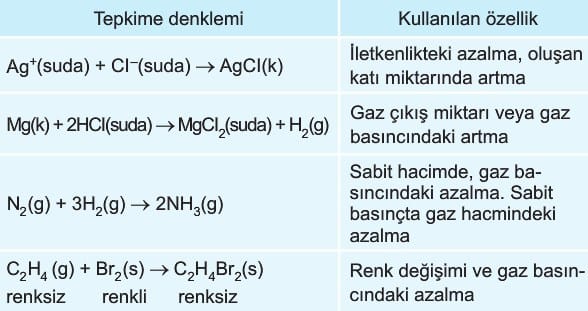
Kimyasal tepkimelerde hız tepkimeye giren maddelerin özelliklerindeki değişimler izlenerek ölçülebilir. Örneğin renk, basınç, hacim, iletkenlik gibi değerlerdeki değişimlerden hız ölçülebilir.
1. Çarpışma Teorisi
Bir kimyasal tepkimenin gerçekleşebilmesi için tepkimeye girecek maddelerin belirli koşulları gerçekleştirmesi gerekir. Bu koşullar,
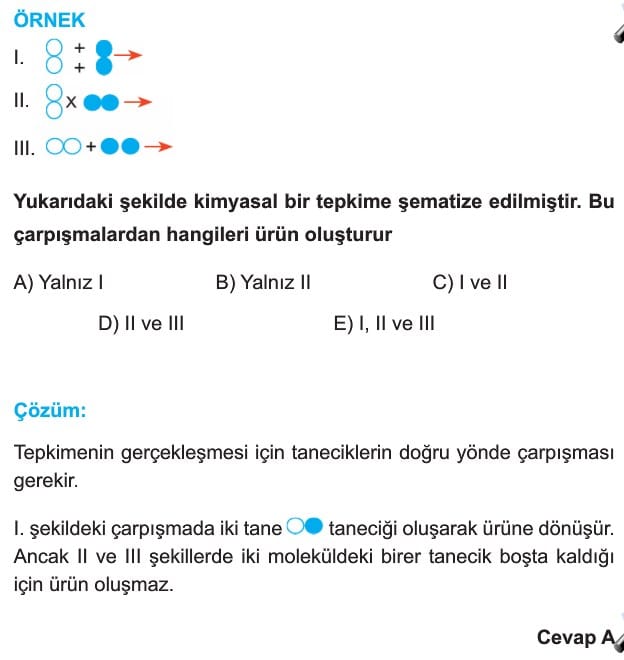
1.1.Tanecikler doğru yönde ve sayıda çarpışmalıdır.
1.2. Taneciklerin yeterli potansiyel enerjiye (aktifleşme enerjisi) sahip olmaları gerekir.
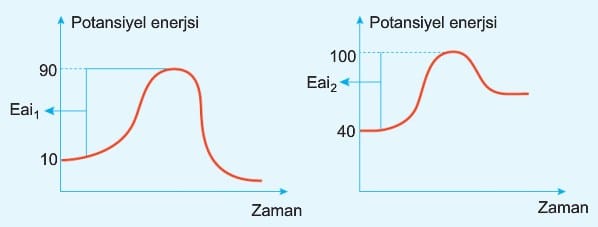
Bir tepkimenin olabilmesi için tepkimeye giren taneciklerin sahip olmaları gereken enerjiye aktifleşme enerjisi denir. Aktifleşme enerjisi yerine, aktivasyon enerjisi, eşik enerjisi gibi terimler de kullanılır.
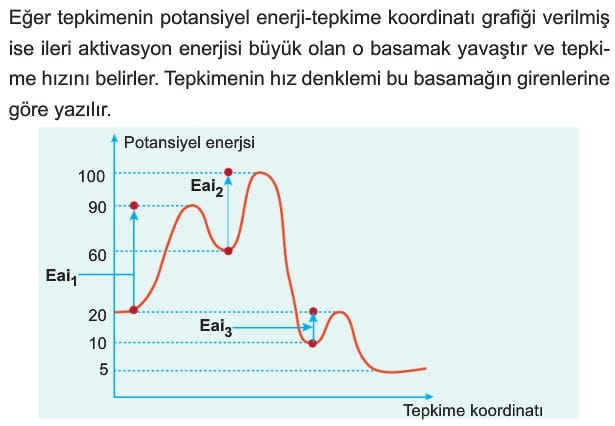
Aktivasyon enerjisine ulaşan tanecikler her zaman ürüne dönüşemeyebilir. Ürün oluşması için diğer koşulların da sağlanması gerekir. İleri aktivasyon enerjisi ne kadar küçük ise tepkime o kadar hızlı gerçekleşir.
Eai1 > Eai2 ise r2 > r1 dir.
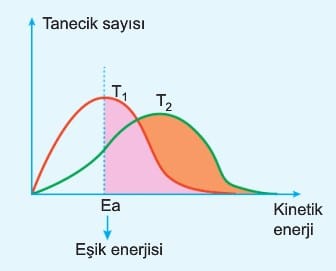
1.3.Tanecikler belirli bir kinetik enerjiye sahip olmalıdır, (eşik enerjisi), başka bir ifadeyle yeterli hıza sahip olmalıdır.
Eşik enerjisini geçen tanecik sayısı arttıkça tepkime hızı artar. Aynı sayıda taneciklerin tepkimesinde T2 sıcaklığında eşik enerjisini geçen tanecik sayısı daha fazla olduğu için T2 > T1 ve r2 > r1 dir. Grafikte ancak taralı bölgedeki tanecikler tepkime verebilir. Tepkimenin gerçekleşmesi için diğer koşulların da sağlanması gerekir. Bu durumda doğru yönde ve sayıda yeterli potansiyel ve kinetik enerjiye sahip taneciklerin çarpışmasına etkin çarpışma (ürün verebilen) denir.
2. Ortalama Hız
Belirli bir zaman aralığında harcanan veya oluşan madde miktarına denır.
Eğer hızın birimi farklı istenirse o birimden harcanan veya oluşan madde miktarı hesaplanır ve geçen zamana bölünür. Örneğin hız g/s olarak istenmiş ise harcanan maddenin kütlesi bulunur ve geçen zamana bölünerek hız hesaplanır.
3. Tek Basamakta Gerçekleşen Tepkimelerde Hız Denkleminin Yazılması
Hız denkleminin yazılmasına geçmeden önce homojen ve heterojen tepkime türlerine bakalım.
Homojen tepkime: Tepkimeye giren ve oluşan maddelerin birbiri içeresinde tamamen dağıldığı tepkimelere denir. Bu tepkimeler ya gaz fazındadır ya da sulu çözeltilerde gerçekleşir.
Heterojen tepkime: Tepkimeye giren ve oluşan maddeler birbiri içerisinde tamamen dağılmamış ise bu tür tepkimelere denir.
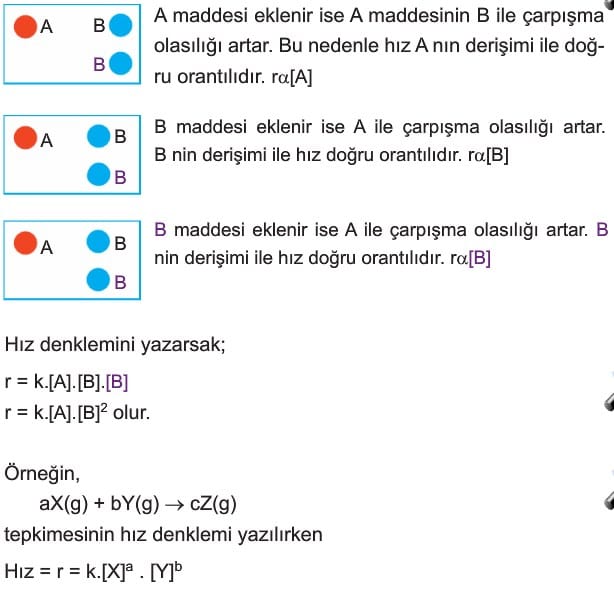
Hız denklemi yazılırken tepkimeye giren maddelerin derişimlerindeki değişmeye göre yazılır. Saf katı ve sıvıların sıcaklık değişmeden derişimleri değişmeyeceğinden hız denkleminde yazılmaz. Bu nedenle hız denkleminde gazlar ve sulu çözeltiler kullanılır. Hız denklemi yazılırken tepkimedeki maddelerin katsayıları hız denkleminde üstel ifade olarak yazılır. Ayrıca her tepkimenin bulunduğu sıcaklığa göre hız sabiti (k) vardır.
A + 2B → C
Tepkimesi için hız denkleminin yazılmasını açıklayalım: Kimyasal tepkimeler çarpışma teorisinin koşullarının gerçekleşmesi ile oluşur.
Hız sabiti (k): Her tepkime için farklı değerde ve birimde olabilir. Tepkimeye giren maddelerin türüne, sıcaklığa, katalizöre, katılar için temas yüzeyine bağlı olarak değişir.
STRATEJİ: Saf katı ve sıvıların hız denkleminde yer almaması onların derişiminin olmadığı anlamına gelmez. Derişimleri vardır ancak hacim ve mol sayıları aynı oranda değişeceği için molariteleri sabittir. Hıza etkileri ise tepkimenin hız sabiti içerisindedir. Bu nedenle katıların temas yüzeyi artıkça hız sabiti artar.
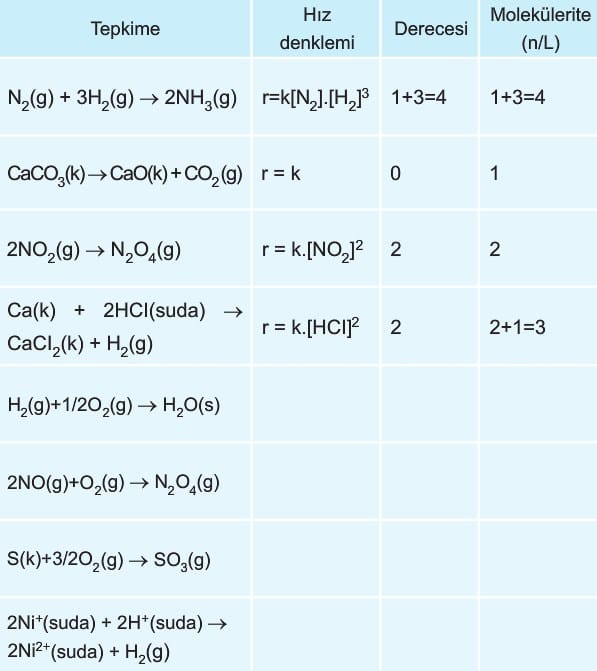
1. Tepkime Derecesi ve Molekülerite
Kimyasal tepkimenin hız denklemindeki üstler toplamına o tepkimenin derecesi (mertebesi) denir. Molekülerite ise ana denklemdeki girenlerin katsayılar toplamıdır. Tepkime derecesi ile molekülerite her zaman aynı olmak zorunda değildir.
Yukarıdaki tabloda verilen tepkimelerin hız denklemi, tepkime derecesi ve moleküleritelerini yazınız.
2. Tepkime Hızlarının Karşılaştırılması
Kimyasal tepkimelerin hızları birbirinden farklıdır. Bazı reaksiyonlar çok hızlı gerçekleşirken bazıları çok yavaştır. Yavaş tepkimeleri hızlandırmak için uygun katalizör kullanılabilir. Örneğin patlama veya nötrleşme tepkimeleri saniye veya milisaniye gibi zamanlarda oluşurken, vücutta proteinlerin sindirimi saatlerce sürmektedir. Bu durumda tepkimeye giren maddelerin türü tepkime hızını etkilemektedir. Tepkime hızları karşılaştırılırken aşağıdaki hususlara dikkat edilmelidir.
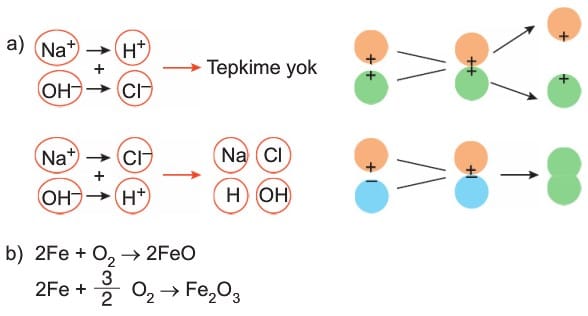
- Zıt yüklü iyonların tepkimesi çok hızlıdır.
- Sadece elektron alışverişi olan tepkimeler hızlıdır.
- Tepkimeye giren maddelerin katsayıları toplamı azaldıkça tepkime hızlanır.
- Ne kadar az bağ kopuyor ve oluşuyor ise tepkime o kadar hızlıdır.
- Büyük moleküllerin parçalanması ve girenlerdeki katsayılar toplamı artıkça tepkime yavaşlar.
4. Mekanizmalı Tepkimelerde Hız Denklemi
Bazı tepkimeler birden fazla adımda gerçekleşir. Bu sırada ara ürünler oluşur ve bu ara ürünlerin tepkimeye girmesi ile istenilen ürün oluşur. Bir başka ifadeyle birkaç tepkimenin toplamı ile istenilen tepkime elde edilir. Bu tarz tepkimelere basamaklı (mekanizmalı) tepkime denir. Bu tepkimelerin hızı basamakların gerçekleşme hızına bağlıdır. Çünkü her tepkimenin farklı aktifleşme enerjisi vardır. Aktifleşme enerjisi büyük olan tepkimenin hızı yavaştır. Bu nedenle ana denklemin hızını da yavaş basamak belirler. Hız denklemi de yavaş basamağın girenlerine göre yazılır.
Bu durumu bir örnekle açıklayalım.
Sulu fazda gerçekleşen yukarıdaki tepkime için hız denklemi I. adıma göre yazılır.
Mekanizmalı tepkimelerde önce oluşup daha sonra harcanan maddelere ara ürün denir. IO– ve HIO oluşup daha sonra harcandığı için ara üründür. Ana denklem ise bu üç tepkimenin toplamıdır.
Mekanizmalı tepkimelerde ana denklem ve hızlı basamak verilmiş ise ana denklemden hızlı adım çıkartılarak yavaş adım bulunabilir.
STRATEJİ: Bir tepkimenin hızını belirlerken aktifleşmiş kompleksin enerjisinin büyüklüğüne değil, bu noktaya çıkmak için ne kadar enerji gerektiğine bakılmalıdır.
Deneylerden Yararlanarak Hız Denkleminin Belirlenmesi
Tepkime hızı tepkimeye giren maddelerin derişimine bağlıdır. Yapılan deneylerde derişimlerdeki değişimin hıza etkisine bakılarak hız denklemi bulunabilir.
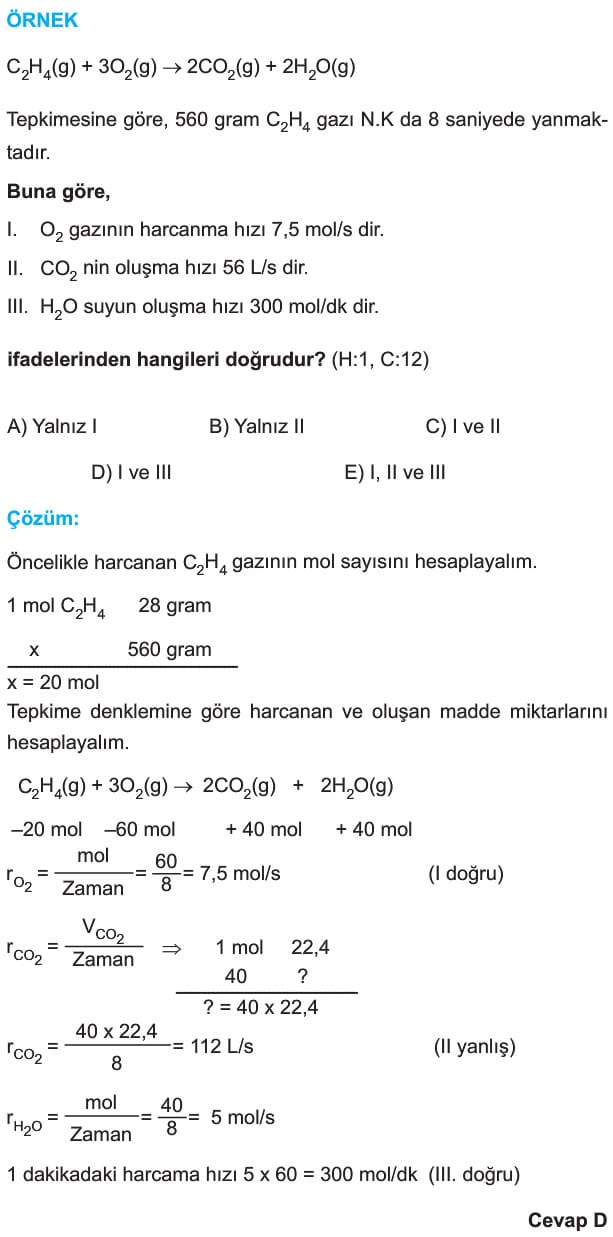
Çözümlü Örnek Test Soruları
Tepkime Hızları
Tepkime hızı, kimyasal reaksiyonlarda reaktanların ürünlere dönüşme hızını ifade eder. Bu hız, zaman içinde birim hacimde değişen madde miktarıyla ölçülür ve çeşitli yöntemlerle hesaplanabilir. Tepkime hızının incelenmesi, reaksiyonların mekanizmasını anlamada önemli bir yer tutar.
1. Aşağıdaki ifadelerden hangisi tepkime hızını doğru tanımlar?
A) Bir kimyasal tepkime sırasında reaktanların tamamının ürünlere dönüşmesi için gereken süre.
B) Belirli bir zaman diliminde, reaktanların mol sayısındaki değişimin oranı.
C) Tepkimenin sonunda elde edilen ürünlerin mol sayısının hesaplanması.
D) Reaksiyon esnasında ortama verilen enerjinin miktarı.
Çözüm: Tepkime hızı, belirli bir zaman diliminde reaktanların mol sayısındaki değişimin oranını ifade eder. Cevap B.
2. Bir tepkimenin hızını hesaplamak için kullanılan genel denklem hangisidir?
A) Hız = Δn / Δt
B) Hız = Δm / ΔT
C) Hız = k [A]ⁿ[B]ᵐ
D) Hız = n/V
Çözüm: Tepkimenin hızı, hız sabiti (k) ile reaktanların derişimlerine bağlı olarak hesaplanır. Genel hız denklemi Hız = k [A]ⁿ[B]ᵐ’dir. Cevap C.
3. A + B → C tepkimesinin hızı, Hız = k [A]²[B] şeklinde verilmiştir. Eğer [A] derişimi iki katına çıkarılır ve [B] sabit tutulursa, tepkimenin hızı nasıl değişir?
A) Hız iki katına çıkar.
B) Hız dört katına çıkar.
C) Hız sabit kalır.
D) Hız yarıya iner.
Çözüm: Hız denklemi Hız = k [A]²[B] olduğuna göre, [A] derişimi iki katına çıkarıldığında hız [A]² ile orantılı olarak dört katına çıkar. Cevap B.
4. Bir kimyasal reaksiyonda tepkime hızını doğrudan etkileyen faktörlerden biri aşağıdakilerden hangisidir?
A) Ürünlerin derişimi
B) Reaktanların konsantrasyonu
C) Tepkime süresi
D) Ürünlerin hacmi
Çözüm: Reaktanların konsantrasyonu, tepkime hızını doğrudan etkileyen önemli bir faktördür. Cevap B.
5. Tepkime hızı hesaplanırken zamanla değişen hangi özellik dikkate alınır?
A) Reaktanların başlangıçtaki mol sayısı
B) Reaktanların derişimindeki azalma
C) Ürünlerin molar hacmi
D) Tepkimenin tamamlanma süresi
Çözüm: Tepkime hızını hesaplamak için zamanla reaktanların derişimindeki azalma dikkate alınır. Cevap B.
6. Aşağıdakilerden hangisi, hız sabiti (k) hakkında doğru bir bilgidir?
A) Sadece sıcaklıkla değişir.
B) Reaktanların konsantrasyonu ile doğrudan ilişkilidir.
C) Sadece ürünlerin miktarına bağlıdır.
D) Tepkime süresiyle orantılıdır.
Çözüm: Hız sabiti (k), tepkimenin sıcaklığına bağlı olarak değişir ve reaktanların derişimlerinden bağımsızdır. Cevap A.