Kimyasal Tepkime Türleri 10. Sınıf Kimya
KİMYASAL TEPKİME TÜRLERİ
Yanma Tepkimeleri
Maddelerin oksijenle birleşmesine yanma denir.
![]()
Metallerin oksijenle birleşmeleri de yanma tepkimesi olup bu olaya oksitlenme ya da paslanma denir.
Odunun, doğal gazın yanması hızlı, demirin paslanması yavaş yanmaya örnektir.

Çözünme – Çökelme Tepkimeleri
İki farklı maddenin birbirlerinin boşluklarına girerek gözle görülmeyecek şekilde homojen olarak dağılmasına çözünme denir.
Şeker, alkol, üre. O2, N2 gibi maddeler suda moleküllerine ayrışarak çözündüğünden bu şekildeki çözünmelere moleküler çözünme denir.
İki farklı madde suda çözündükten sonra iyonlar kendi arasında yer değiştirerek farklı bileşikler oluşur. Bu sırada suda çözünmeyen bir maddenin oluşmasıyla gerçekleşen tepkimelere de çözünme – çökelme tepkimesi denir.
![]()
tepkimesinde AgNO, ve NaCl çözünmüş, iyonlar arasındaki birleş-
meler sonucu suda çok az çözünen AgCi katısı oluşarak çökelme
gerçekleşmiştir.
Bu tepkimelerde çökelek oluşturmayan iyonlara seyirci iyon denir.
Çökelmeyi gerçekleştiren tepkimeye de net tepkime denklemi denir.
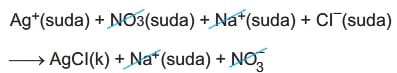
tepkimesi de net tepkime denklemi olarak tanımlanır.
Sentez (Oluşma) Tepkimeleri
Basit maddelerin tepkimeye girerek daha kompleks maddelerin oluştuğu tepkimelerdir.
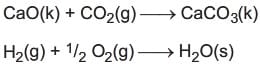
Analiz (Ayrışma) Tepkimeleri
Kompleks maddelerin ayrışarak daha basit maddelerin oluştuğu tepkimelerdir.
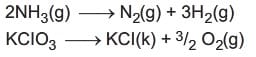
Asit – Baz Tepkimeleri
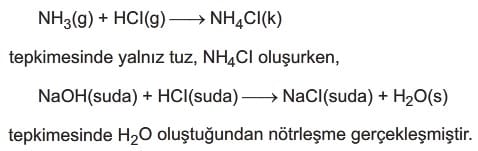
Bir asit ile bir bazın tepkimesinden oluşan kimyasal olaydır. Bu tepkimlerde tuz, genellikle de su açığa çıkar.
Bir asit – baz tepkimesinde tuzun yanında su da açığa çıkıyorsa bu tepkimelere nötrleşme tepkimesi denir.
Kimyasal tepkimelerde parantez içindeki harfler maddenin fiziksel halini belirtir gaz (g), sıvı (s), katı (k) gibi suda çözünen bir maddenin sulu çözeltisi içinde (suda), (sulu), (çöz) şeklinde parantez içinde yazılarak belirtilebilir.
Kimyasal bir tepkimede;
Atom sayısı
Atomların cinsi
Toplam kütle
Toplam proton sayısı
Toplam nötron sayısı
Toplam elektron sayısı
Toplam yük
Çekirdek yapısı
gibi özellikler korunurken;
Molekül sayısı
Mol sayısı
Hacim
Kimyasal özellik (değişir)
Fiziksel özellik (değişir)
Bileşik sayısı
Atomların elektron sayısı
Atomların hacmi
gibi özellikler değişir / değişebilir.
Çözümlü Örnek Test Soruları
Soru 1:
Aşağıdaki tepkimelerden hangisi yanma tepkimesine örnektir?
A) 2H₂ + O₂ → 2H₂O
B) Na + Cl₂ → NaCl
C) CaCO₃ → CaO + CO₂
D) N₂ + 3H₂ → 2NH₃
E) AgNO₃ + NaCl → AgCl + NaNO₃
Çözüm: Yanma tepkimesi, bir maddenin oksijenle tepkimeye girerek oksitlenmesiyle oluşur. Burada oksijen gazıyla tepkimeye girerek su oluştuğu için doğru cevap A şıkkıdır.
Soru 2:
Hangi tepkime bir ayrışma tepkimesidir?
A) 2KClO₃ → 2KCl + 3O₂
B) H₂ + Cl₂ → 2HCl
C) NaOH + HCl → NaCl + H₂O
D) Zn + CuSO₄ → ZnSO₄ + Cu
E) CH₄ + O₂ → CO₂ + H₂O
Çözüm: Ayrışma tepkimelerinde bir bileşik, daha basit maddelere ayrışır. A şıkkındaki tepkimede KClO₃ bileşiği, KCl ve O₂’ye ayrıştığı için doğru cevap A şıkkıdır.
Soru 3:
Aşağıdakilerden hangisi bir sentez (birleşme) tepkimesidir?
A) 2SO₂ + O₂ → 2SO₃
B) 2H₂O₂ → 2H₂O + O₂
C) Mg + 2HCl → MgCl₂ + H₂
D) NaOH + HCl → NaCl + H₂O
E) C + O₂ → CO₂
Çözüm: Sentez tepkimelerinde iki veya daha fazla madde bir araya gelerek yeni bir bileşik oluşturur. A şıkkındaki tepkimede SO₂ ve O₂ birleşerek SO₃ oluşturduğu için doğru cevap A şıkkıdır.
Soru 4:
Aşağıdaki tepkimelerden hangisi bir yer değiştirme tepkimesidir?
A) Zn + 2HCl → ZnCl₂ + H₂
B) CaCO₃ → CaO + CO₂
C) H₂ + Cl₂ → 2HCl
D) C + O₂ → CO₂
E) 2KClO₃ → 2KCl + 3O₂
Çözüm: Yer değiştirme tepkimelerinde bir element, bir bileşikteki diğer elementi yerinden çıkarır. A şıkkındaki tepkimede Zn, HCl bileşiğindeki H’yi yerinden çıkararak ZnCl₂ ve H₂ oluşturduğu için doğru cevap A şıkkıdır.
Soru 5:
Aşağıdaki tepkimelerden hangisi çift yer değiştirme tepkimesine örnektir?
A) AgNO₃ + NaCl → AgCl + NaNO₃
B) H₂ + O₂ → H₂O
C) Na + Cl₂ → NaCl
D) CaCO₃ → CaO + CO₂
E) 2KClO₃ → 2KCl + 3O₂
Çözüm: Çift yer değiştirme tepkimelerinde, iki bileşikteki iyonlar karşılıklı olarak yer değiştirir. A şıkkında AgNO₃ ve NaCl arasında iyon değişimi gerçekleştiği için doğru cevap A şıkkıdır.
Soru 6:
Hangi tepkime asit-baz nötrleşme tepkimesine örnektir?
A) HCl + NaOH → NaCl + H₂O
B) CH₄ + 2O₂ → CO₂ + 2H₂O
C) CaCO₃ → CaO + CO₂
D) Zn + H₂SO₄ → ZnSO₄ + H₂
E) H₂ + Cl₂ → 2HCl
Çözüm: Nötrleşme tepkimelerinde bir asit ve bir baz tepkimeye girerek tuz ve su oluşturur. A şıkkında HCl (asit) ve NaOH (baz) birleşerek NaCl ve H₂O oluşturduğu için doğru cevap A şıkkıdır.