Bohr Atom Modelinin Sınırlılıkları 11.Sınıf Kimya
Bohr Atom Modelinin Sınırlılıkları Ders Notu
Niels Bohr hidrojen atomunun çizgi spektrumlarını incelemiş ve bu çizgileri elektronun hareketleri ile ilişkilendirerek yörünge kavramına dayanan bir atom modeli geliştirmiştir. Geliştirdiği bu modelde elektronların çekirdek etrafındaki belirli enerjiye sahip dairesel yörüngelerde hareket ettiğini öne sürmüştür. Bohr atom modeli ile tek elektronlu atom ve iyonların spektrum çizgilerini başarılı bir şekilde açıklanabilir. Fakat bu model öne sürüldükten kısa bir süre sonra birçok bilimsel çalışma yapılmış ve bu çalışmalar sonucunda elektron ile ilgili yeni bilgilere ulaşılmıştır.
Bu çalışmalar sonucunda elde edilen bilgiler ve ulaşılan sonuçlardan bazıları;
Louis De Broglie tarafından elektronun dalga-tanecik özelliği gösterdiğinin öne sürülmesi ve bununla ilişkili deneysel kanıtların elde edilmesi,
Werner Heisenberg tarafından elektronun hızı ve konumunun aynı anda kesin olarak belirlenemeyeceğinin hesaplamalar ile kanıtlanması,
Erwin Schrödinger tarafından elektronun enerjisi ve hareketini açıklayan bir dalga denklemi oluşturulması ve bunun sonucunda elektronun atom çekirdeği etrafındaki olası konumlarını belirten orbital kavramının geliştirilmesidir.
Bu tür bilimsel gelişmelere bağlı olarak Bohr atom modeli tartışmalı hâle gelmiş ve kısa süre içinde geçerliliğini yitirmiştir. Bohr modelinin bazı eksik ve hatalı yanları arasında, modelin temelini oluşturan yörünge kavramının yanlış oluşu, modelde elektronun dalga özelliğinin yok sayılması ve çok elektronlu atom ve iyonların spektrum çizgilerini açıklamadaki başarısızlıkları sayılabilir.
Bu gibi yetersizlikler nedeniyle elektronun hareketini açıklamak için yeni bilgiler ışığında Modern Atom Teorisi oluşturulmuştur.
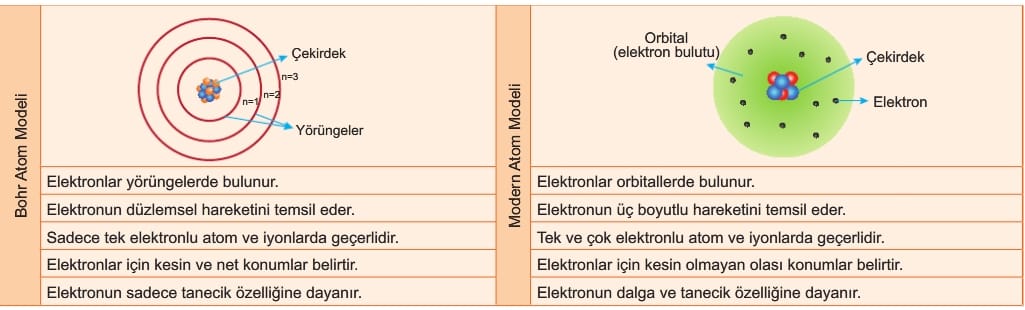
Modern modele göre elektronlar atom çekirdeği etrafındaki orbitallerde (elektron bulutu) hareket eder. Orbitaller yörüngeler gibi kesin yerler belirtmez. Sadece elektronun çekirdek etrafında bulunma olasılığının yüksek olduğu hacimleri ifade eder. Aşağıda Bohr atom modeli ve modern atom modeli kısaca karşılaştırılmıştır.