Kimyasal Tepkimeler ve Denklemler 10. Sınıf Kimya
Kimyasal Tepkimelerin Denklemleri
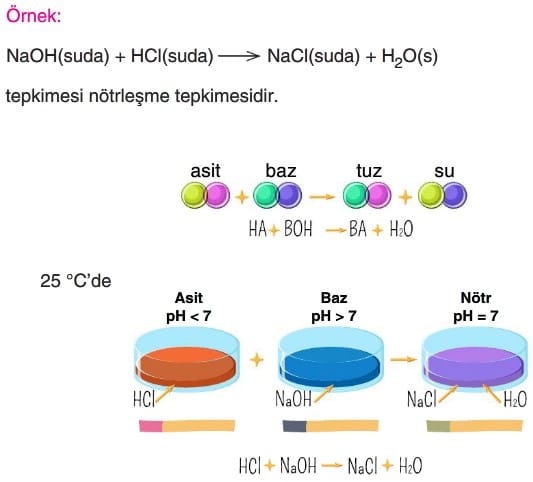
Kimyasal tepkimeler tepkime denklemi ile gösterilir. Bir kimyasal tepkimeye giren ve tepkimede oluşan elementlerin sembol, bileşiklerin ise formülle gösterildikleri, girenlerle ürünlerin bir ok (→) sembolü ile birbirinden ayrıldığı kısa ifade biçimine tepkime denklemi denir. Bu tanımdan da anlaşıldığı gibi başlangıçtaki (harcanan) maddelere girenler veya reaktifler, tepkime sonucunda oluşan maddelere de çıkanlar veya ürünler denir.
Genel olarak kimyasal tepkimeler,
Reaktifler → Ürünler
şeklinde gösterilir.
Reaktifler ve ürün maddelerinin fiziksel durumu ilgili maddenin formülünden sonra parantez içinde yazılan harfle belirtilir.
* katı → (k)
* sıvı → (s)
* gaz → (g)
* suda çözünmüş → (suda) ya da (ag)


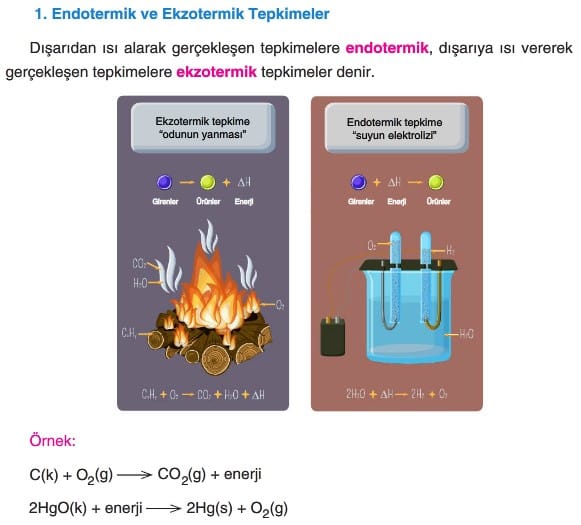
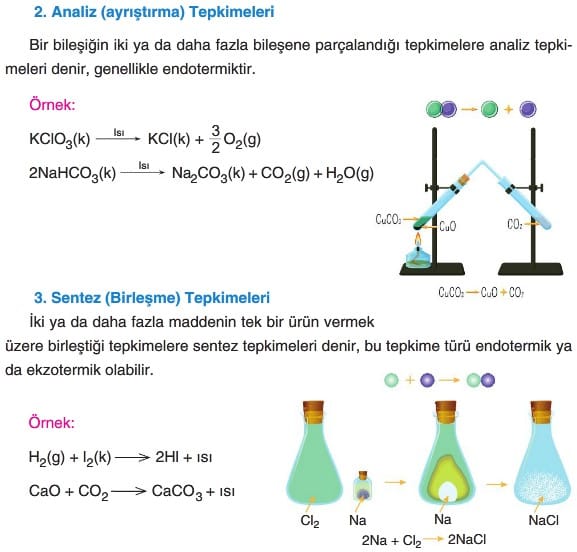




Kimyasal Tepkimelerde Korunan Özellikler
* Atomların cinsi
* Atomların sayısı
* Atomların çekirdek yapısı
* Toplam proton sayısı
* Toplam elektron sayısı
* Toplam nötron sayısı
* Toplam kütle
* Toplam yük
* Enerji

Kimyasal Tepkimelerde Korunmayan Özellikler
* Fiziksel ve kimyasal özellikler
* Molekül yapısı
* Nötr atomların elektron sayısı
* Nötr atomların çapı
Homojen Tepkime; Tüm türlerin fiziksel hallerinin aynı olduğu tepkimelerdir.

Çözümlü Örnek Test Soruları
Kimyasal Tepkimeler ve Denklemler
- Aşağıdaki denklemlerden hangisi doğrudur?
A) H₂ + O₂ → H₂O
B) 2H₂ + O₂ → 2H₂O
C) H₂ + O → H₂O
D) H₂ + O₂ → 2H₂O₂Çözüm: Doğru denkleme göre, 2 mol hidrojen (H₂) ve 1 mol oksijen (O₂), 2 mol su (H₂O) üretir. Doğru cevap B‘dir.
- Kimyasal bir tepkimede 2 mol H₂ ve 1 mol O₂ birleşerek kaç mol H₂O oluşturur?
A) 1 mol
B) 2 mol
C) 3 mol
D) 4 molÇözüm: Denkleme göre 2 mol H₂ ve 1 mol O₂, 2 mol H₂O oluşturur. Doğru cevap B‘dir.
- Kimyasal denklemler neden denkleştirilmelidir?
A) Kütlenin korunumu kanununa uymak için
B) Sabit oranlar kanununa uymak için
C) Tepkimenin hızını artırmak için
D) Gaz hacmini artırmak içinÇözüm: Kimyasal denklemler, kütlenin korunumu kanununa göre denkleştirilir. Giren maddelerin toplam kütlesi, ürünlerin toplam kütlesine eşit olmalıdır. Doğru cevap A‘dır.
- Aşağıdaki tepkimelerden hangisi yanlıştır?
A) N₂ + 3H₂ → 2NH₃
B) 2H₂ + O₂ → 2H₂O
C) C + O₂ → CO₂
D) Na + Cl₂ → 2NaClÇözüm: Na + Cl₂ tepkimesinde NaCl’nin oluşması için tepkime şu şekilde olmalıdır: 2Na + Cl₂ → 2NaCl. Doğru cevap D‘dir.
- 1 mol metan (CH₄) yakıldığında kaç mol su oluşur? (Tepkime denklemi: CH₄ + 2O₂ → CO₂ + 2H₂O)
A) 1 mol
B) 2 mol
C) 3 mol
D) 4 molÇözüm: Denkleme göre, 1 mol CH₄ yakıldığında 2 mol H₂O oluşur. Doğru cevap B‘dir.
- 2 mol C₃H₈ yakıldığında kaç mol CO₂ oluşur? (Tepkime denklemi: C₃H₈ + 5O₂ → 3CO₂ + 4H₂O)
A) 2 mol
B) 3 mol
C) 4 mol
D) 6 molÇözüm: Denkleme göre, 1 mol C₃H₈ yakıldığında 3 mol CO₂ oluşur. 2 mol C₃H₈ için 2 * 3 = 6 mol CO₂ oluşur. Doğru cevap D‘dir.
10.sınıf kimyasal tep. konusu 1.örnek hatalı