Kaynama Sıcaklığı 9. Sınıf Kimya
Kaynama sıcaklığı, bir maddenin sıvı halden gaz hale geçmeye başladığı sıcaklık derecesidir. 9. sınıf kimya müfredatında kaynama sıcaklığı, bir maddenin fiziksel bir özelliği olarak incelenir ve moleküller arası etkileşimlerle ilişkilendirilir. Kaynama sıcaklığı, maddenin türüne, moleküller arası kuvvetlere ve basınca bağlı olarak değişir.
Kaynama Sıcaklığı
Sıvının buhar basıncının dış basınca (atmosfer basıncı) eşit olduğu durumda sıvının buharlaşarak kaynamaya başladığı sıcaklığa kaynama sıcaklığı denir. Eğer bu olay, dış basınç 1 atm (760 mmHg) olduğu bir ortamda gerçekleşiyorsa, buna normal kaynama noktası denir.
Kaynama Sıcaklığını Etkileyen Faktörler
- Sıvının Türü
- Dış Basınç
- Safsızlık
| Molekül | Kaynama Sıcaklığı (°C) | Atomların Elektronegatiflik Değerleri |
|---|---|---|
| H₂O | 100 | H: 2,20 O: 3,44 |
| HF | 19,5 | H: 2,20 F: 4,00 |
| NH₃ | -33,3 | H: 2,20 N: 3,04 |
1. Sıvının Türü
- Moleküller arası çekim kuvvetleri, maddelerin kaynama sıcaklıklarını etkileyen önemli faktörlerden biridir. Moleküller arası çekim kuvvetleri büyük olan sıvıların kaynama sıcaklığı daha yüksek olur. Örneğin, uçucu olmayan ve sadece London kuvvetleri tarafından etkilenebilen CH₄’ün kaynama noktası -160,5°C iken, dipol – dipol etkileşimi olan H₂S’nin kaynama sıcaklığı -60°C’dir. Hidrojen bağı içeren H₂O’nun kaynama noktası ise 100°C gibi çok daha yüksek bir değerdir.
- Hidrojen bağı içeren sıvılar, daha güçlü çekim kuvvetleri nedeniyle daha yüksek kaynama sıcaklıklarına sahiptir. Örneğin, HF ve H₂O molekülleri arasındaki hidrojen bağları, HF molekülü ile HF molekülü arasında da etkileşim oluşturur. Bu sebeple H₂O’nun kaynama noktası HF’e göre daha yüksektir.
- Hidrojen bağları içeren HF ve NH₃’ün kaynama sıcaklıkları karşılaştırıldığında, HF’in kaynama sıcaklığı daha yüksek olduğu görülür. Bunun nedeni, HF molekülündeki flor ve hidrojen atomları arasındaki elektronegatiflik farkının NH₃ molekülündeki azot ve hidrojen arasındaki farktan daha büyük olmasıdır. Böylece HF molekülleri arasındaki çekim kuvveti daha güçlüdür.
2. Dış Basınç
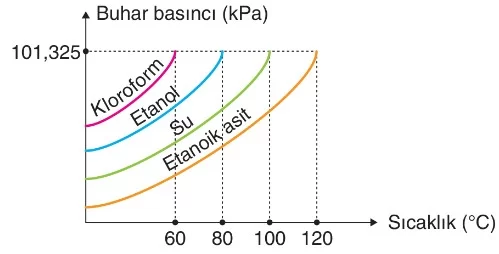
Saf bir sıvının kaynama sıcaklığı, sıvının yüzeyine etki eden dış basınca bağlıdır. Kaynamanın gerçekleşmesi için sıvının buhar basıncının dış basınca eşit olması gereklidir. Sıvının yüzeyine uygulanan dış basınç yüksek olduğunda, kaynamanın gerçekleşebilmesi için sıvının buhar basıncının da yüksek olması gerekir. Yüksek buhar basıncına ulaşmak için sıvı daha fazla ısı alır ve bu da kaynama noktasını yükseltir. Dolayısıyla dış basınç arttıkça sıvıların kaynama noktası artar; dış basınç azaldıkça kaynama noktası düşer.
- Aynı ortamda kaynayan farklı sıvıların kaynamaları sırasında buhar basınçları eşittir.
- Sabit basınç altında kaynama sırasında saf sıvıların sıcaklıkları değişmez.
- Deniz seviyesinden yükseldikçe açık hava basıncı azalır, dolayısıyla sıvıların kaynama noktası düşer.
- Everest Dağı’nda dış basınç 255 mmHg olup saf suyun kaynama noktası 72°C iken, deniz seviyesinde dış basınç 760 mmHg olup saf suyun kaynama noktası 100°C’dir.
3. Safsızlık
- Sıvı içindeki safsızlıklar kaynama noktasını etkiler. Saf olmayan sıvılarda kaynama sıcaklığı yükselir çünkü safsızlıklar sıvının buhar basıncını düşürür ve kaynama noktasını arttırır. Örneğin, tuzlu suyun kaynama noktası saf suya göre daha yüksektir.
Sıvının Saflık Derecesi
Bir sıvıdaki uçuculuğu sudan daha az olan tuz veya şeker gibi katı maddelerin çözünmesi, çözeltinin kaynama sıcaklığını artırır. Örneğin, 1 atm basınç altında saf suyun kaynama sıcaklığı 100°C iken, şekerli suyun kaynamaya başlama sıcaklığı 100°C’nin üzerine çıkar. Çözünen maddenin miktarı arttıkça kaynama sıcaklığı da yükselir.
Kaynama ve Buharlaşmanın Farkları
- Buharlaşma her sıcaklıkta meydana gelirken, kaynama belirli bir sıcaklıkta gerçekleşir.
- Buharlaşma sıvının yüzeyinde, kaynama ise sıvının her yerinde gerçekleşir.
- Dış basınç buharlaşmayı etkilemez ancak kaynama sıcaklığını doğrudan etkiler.
- Sıvının yüzey alanı buharlaşma hızını etkiler, fakat kaynama noktasını etkilemez.
- Sıvıda uçucu olmayan katıların çözünmesi kaynama noktasını yükseltir, ancak bu buharlaşma hızını azaltır.
- Moleküller arası çekim kuvveti arttıkça kaynama noktası yükselir, bu da buharlaşma hızını yavaşlatır.
- Kaynama hızı, buharlaşmadan daha hızlı gerçekleşir.
- Buharlaşmada kabarcık oluşmazken, kaynama sırasında kabarcıklar meydana gelir.
Çözümlü Örnek Sorular
Soru 1
Aşağıdaki faktörlerden hangisi bir sıvının kaynama noktasını etkiler?
A) Sıvının hacmi
B) Ortamın basıncı
C) Sıvının rengi
D) Sıvının bulunduğu kap
Çözüm:
Kaynama noktası, ortamın basıncına bağlıdır. Basınç arttıkça sıvının kaynama noktası yükselir, basınç azaldıkça ise kaynama noktası düşer.
Doğru cevap: B
Soru 2
Bir sıvının kaynaması sırasında hangisi doğrudur?
A) Sıvının sıcaklığı sürekli artar
B) Sıvının buhar basıncı ortam basıncına eşitlenir
C) Sıvının moleküller arası kuvvetleri güçlenir
D) Sıvıdan ısı alınır
Çözüm:
Bir sıvı kaynama sırasında, sıvının buhar basıncı ortam basıncına eşitlenir ve bu nedenle sıvı kaynamaya başlar.
Doğru cevap: B
Soru 3
Deniz seviyesinden daha yüksek bir rakımda kaynayan suyun kaynama noktası nasıl değişir?
A) Artar
B) Azalır
C) Değişmez
D) Önce artar, sonra azalır
Çözüm:
Yüksek rakımlarda atmosfer basıncı daha düşük olduğu için suyun kaynama noktası düşer.
Doğru cevap: B
Soru 4
Aşağıdaki sıvılardan hangisinin kaynama noktası en yüksektir?
A) Etil alkol
B) Su
C) Aseton
D) Zeytinyağı
Çözüm:
Zeytinyağı, moleküller arası kuvvetlerin daha güçlü olduğu bir sıvıdır ve kaynama noktası, diğer seçeneklere göre daha yüksektir.
Doğru cevap: D
Soru 5
Bir sıvının kaynama noktası nasıl tanımlanır?
A) Sıvının buhar basıncının atmosfer basıncına eşit olduğu sıcaklık
B) Sıvının buharlaşmaya başladığı sıcaklık
C) Sıvının tamamen buharlaştığı sıcaklık
D) Sıvının ısıya karşı direnç gösterdiği sıcaklık
Çözüm:
Kaynama noktası, bir sıvının buhar basıncının atmosfer basıncına eşit olduğu sıcaklıktır.
Doğru cevap: A