Elektron Dizilimleri 11.Sınıf Kimya
Elektron Dizilimi Kuralları
Atomların elektron dizilimleri Aufbau prensibine göre, orbital şemaları Pauli ilkesi ve Hund kuralına göre oluşturulur.
Aufbau Prensibi
Bu prensibe göre elektronlar orbitallere düşük enerjili orbitalden başlanarak yüksek enerjili orbitallere doğru ilerleyerek orbitallerin aşağıdaki enerji artış sırasına uygun olarak yerleştirilir.

Bu sıralamadaki çizgiler ile ayrılmış bölümler soy gaz atomlarının elektron dizilimlerine karşılık gelir.
Pauli İlkesi
Bu ilkeye göre bir orbitaldeki iki elektronun tüm kuantum sayıları (n, l,ml, ms) aynı olamaz.
Bu nedenle bir orbital en fazla zıt spinli ilielektronlu dolu orbital (l) şeklinde gösterilir.
![]()
Hund Kuralı
Bu kurala göre eş enerjili orbitallerdeki elektronların en kararlı dizilimi, aynı spine sahip elektronların en çok olduğu dizilimdir. Bu nedenle elektronlar eş enerjili orbitallere önce aynı spinle birer birer yerleştirilir, daha sonra bu orbitaller kalan elektronlarla zıt spinli olacak şekilde iki elektrona tamamlanır. Örneğin bu kurala göre eş

Temel Hâl Elektron Dizilimi
Atomun düşük enerjili ve kararlı nötr hâline temel hâl denir. Temel hâl elektron dizilimi Aufbau prensibine bağlı olarak aşağıdaki orbital enerji sırasına göre oluşturulur.

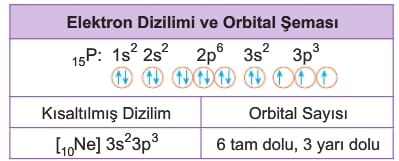
Dizilime ait orbital şeması oluşturulurken de Hund Kuralı ve Pauli İlkesi’den yararlanılır. Bu kurallara göre fosfor (15P) atomunun temel hâl elektron dizilimi ve orbital şeması aşağıdaki gibi olur.


İyonların Elektron Dizilimi
Nötr bir atom elektron verdiğinde katyon (pozitif yüklü iyon), elektron aldığında anyon (negatif yüklü iyon) oluşur. Elektron dizilimi elektronların orbitallere yerleşimini belirttiğinden iyonların elektron dizilimleri oluşturulurken atomun aldığı veya verdiği elektron sayısı göz önünde bulundurulmalıdır.
Anyonların Elektron Dizilimi
Nötr bir atom, anyon hâline geçerken atomun aldığı elektronlar tam dolu olmayan en son orbitallerine yerleşir. Bu nedenle anyonların elektron dizilimi oluşturulurken atomun aldığı elektron sayısı nötr haldeki elektron sayısına eklenerek önceden belirttiğimiz sıraya uygun olarak yeni dizilim oluşturulur. Örneğin fosfor (P) ve germanyum (Ge) element atomlarının temel haldeki elektron dizilimleri aşağıdaki gibidir.

Katyonların Elektron Dizilimi
Nötr bir atom, katyon hâline geçerken elektronlar öncelikle baş kuantum sayısı (n) en büyük olan orbitalden, baş kuantum sayısı eşit olan orbitallerde ise açısal momentum kuantum sayısı (l) daha büyük olan orbitalden öncelikle ayrılır.
Bu nedenle katyonların elektron dizilimi oluşturulurken öncelikle elektronların orbitallerden ayrılacağı sıra belirlenir, daha sonra bu sıraya göre ayrılan elektron sayısı kadar elektron orbitallerden eksiltilerek yeni dizilim oluşturulur.
Örneğin mangan (Mn) ve arsenik (As5+) element atomlarının temel haldeki elektron dizilimleri aşağıdaki gibidir.

Elektron Dizilimleri 11. sınıf kimya konu anlatımı soru ve çözümleri ders notu
Katyonlarda ise iyon yükü değeri kadar elektron atomdan koparılır. Elektronların koparılması en dış orbitalden gerçekleşir. Örneğin elektron dizilimi 45 3d 4p şeklinde olan bir atomdan sırasıyla elektron 4p, 4s ve 3d orbitalinden koparılır. Farklı atomların iyon hallerinin elektron dizilimi aynı olabilir. Bu durumdaki iyonlara birbirinin izoelektroniği denir. Özellikle katyonların elektron dizilimi yapılırken doğrudan elektron sayısına göre değil, proton sayısına göre dizilim yapılıp daha sonra elektronlar koparılır.