Tepkimelerde Isı Değişimi 11. sınıf kimya
Doğada ve laboratuvar şartlarında gerçekleşen birçok fiziksel ve kimyasal değişimler enerji eşliğinde gerçekleşir. Maddeler bulunduğu ortam ile enerji alış verişi yapabilir. Bu enerjinin türü kinetik, potansiyel ya da mekanik iş şeklinde olabilir ancak bu ünitede ısı enerjisi üzerinde durulacaktır. Isı, sıcaklıkları farklı olan cisimler arasında transfer edilen bir enerji türüdür. Kimyasal bir tepkime gerçekleşirken tepkime ortamına ısı verilebildiği gibi (Ekzotermik) ortamdan ısı da alınabilir (Endotermik). Doğada ve laboratuvarda gerçekleşen tepkimeler genelde sabit bir dış basınç altında gerçekleşir.
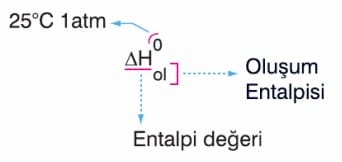
Bu şekilde sabit basınçlı bir ortamda fiziksel ya da kimyasal bir olaya eşlik eden ısı enerjisi miktarına Entalpi denir. Entalpi değeri doğrudan ölçülemeyen bir hal fonksiyonudur. Diğer bir ifade ile entalpi gerçekleşen bir değişimde ilk ve son durumdaki ısı miktarının farkını belirtir. Bu yüzden ΔH sembolü ile İfade edilir. Entalpi değeri standart koşullarda (25°C, tatm) hesaplanır ise bu değer Standart Oluşum Entalpisi olarak adlandırılır ve ΔH0 sembolü ile belirtilir.
Elementler bilindiği üzere doğada allotropları halinde bulunur. Örneğin oksijen elementi O2 (Oksijen) ve O3 (Ozon) halinde karbon C(Grafit) ve C(Elmas) doğal allotropları halinde bulunur. Elementlerin doğada bulundurduğu en kararlı allotropunun standart oluşum entalpisi sıfır’dır. Çünkü bu maddeler doğal bir oluşum ile meydana gelmiştir. Ancak en kararlı allotrop’un diğer formlarına dönüşümü enerji gerektirdiği için bir enerji değişimi gerçekleşir.
Oksijen elementinin allotroplarından O2 (0ksijen gazı)’nın standart oluşum entalpisi sıfır alınabilirken O3 (Ozon gazı)’ün entalpisi sıfır alınamaz. Karbon allotroplarından C(Grafit) sıfır alınabilirken C(Elmas)‘ın standart oluşum entalpisi sıfırdan farklıdır. Aşağıda bazı elementlerin en kararlı halleri verilmiştir.
Elementler bir araya gelerek bileşikleri oluşturur. Elementlerin oluşum entalpileri sıfır alınarak bileşiklerin oluşum entalpileri hesaplanabilir. Bir mol bileşiğin 25°C, sıcaklık 1 atm basınçta kararlı elementlerinden oluşması sırasındaki ısı değişimine Standart Molar Oluşum Entalpisi denir.
Tepkime denklemlerinde sırasıyla CO2 ve H2O’nun standart molar oluşum entalpileri verilmiştir.
- Bir tepkime sırasında ortamdan ısı alınabilir ya da ortama ısı verilebilir. Bulunduğu ortamdan ısı alarak gerçekleşen olaylar endotermik, bulunduğu ortama ısı vererek gerçekleşen olaylar ise ekzotermiktir.
Tepkime Entalpisi (Isısı):
Bir kimyasal tepkime sırasında gerçekleşen ısı değişimine tepkime entalpisi denir.
Tepkime entalpisi gerçekleşen tepkime denklemine göre isim değiştirebilir. Yani bir oluşum tepkimesi için oluşum entalpisi, yanma tepkimesi için yanma entalpisi ve nötrleşme tepkimesi için nötrleşme tepkimesi için nötrleşme entalpisi ifadeleri kullanılır.
Çözümlü Örnek Test Soruları
Tepkimelerde Isı Değişimi
Kimyasal tepkimelerde ısı değişimi, reaksiyonun endotermik veya ekzotermik olmasına bağlı olarak farklılık gösterir. Bir tepkime sırasında açığa çıkan veya soğurulan ısı miktarı, kimyasal bağların kopması ve oluşması ile ilgilidir.
1. Bir kimyasal tepkime sırasında çevreye ısı verilmesi ve sistemin sıcaklığının artması durumunda bu tepkimenin hangi türden olduğu söylenebilir?
A) Endotermik tepkime
B) Ekzotermik tepkime
C) Sabit sıcaklıklı tepkime
D) Isı değişiminin olmadığı tepkime
Çözüm: Çevreye ısı veren tepkimeler ekzotermik tepkimelerdir. Bu tür tepkimelerde sistem ısı kaybeder ve çevre ısınır. Cevap B.
2. Aşağıdaki olaylardan hangisi bir endotermik reaksiyona örnektir?
A) Bir odunun yanması
B) Kirecin su ile tepkimesi
C) Buzun erimesi
D) Su buharının yoğunlaşması
Çözüm: Endotermik tepkimeler, dışarıdan ısı alarak gerçekleşen olaylardır. Buzun erimesi dışarıdan ısı aldığı için endotermik bir süreçtir. Cevap C.
3. Bir tepkimenin entalpi değişimi -150 kJ/mol olarak verilmiştir. Bu tepkimeyle ilgili aşağıdaki ifadelerden hangisi doğrudur?
A) Tepkime ekzotermiktir, ısı açığa çıkar.
B) Tepkime endotermiktir, ısı soğurulur.
C) Tepkimenin entalpi değişimi sıfırdır.
D) Tepkime ısı alışverişi yapmaz.
Çözüm: Negatif bir entalpi değişimi (-150 kJ/mol), tepkimenin ekzotermik olduğunu ve ısı açığa çıktığını gösterir. Cevap A.
4. 100 gram suyun sıcaklığı 10°C’den 50°C’ye çıkarıldığında suyun aldığı ısı miktarı kaç kJ’dür? (Suyun özgül ısısı 4,18 J/g°C’dir.)
A) 16,72 kJ
B) 12,54 kJ
C) 4,18 kJ
D) 20,90 kJ
Çözüm: Q = m * c * ΔT formülü kullanılarak suyun aldığı ısı hesaplanır.
Q = 100 g * 4,18 J/g°C * (50°C – 10°C)
Q = 100 * 4,18 * 40 = 16.720 J = 16,72 kJ. Cevap A.
5. Aşağıdaki olaylardan hangisinde ısı açığa çıkar?
A) Amonyum nitratın suda çözünmesi
B) Buğunun suya dönüşmesi
C) Şekerin eritilmesi
D) Buzun suya dönüşmesi
Çözüm: Buğunun suya dönüşmesi (yoğunlaşma) ekzotermik bir süreçtir ve ısı açığa çıkar. Cevap B.
6. Bir ekzotermik tepkimede aşağıdaki özelliklerden hangisi değişebilir?
A) Tepkime sırasında ısı çevreye verilir.
B) Ürünlerin entalpisi reaktanlardan daha yüksektir.
C) Reaktanların enerjisi üründen daha düşüktür.
D) Çevreye ısı vermediği için enerji soğurur.
Çözüm: Ekzotermik tepkimelerde reaktanların enerjisi, ürünlerden daha yüksektir ve bu nedenle ısı çevreye verilir. Cevap C.