Tepkime Hızını Etkileyen Faktörler 11. sınıf kimya
Tepkime hızını, birim zamanda gerçekleşen etkin çarpışma sayısı olarak ifade ettiğimize göre, etkin çarpışma sayısını artıran etkenler tepkime hızını da arttıracaktır.
Tepkime hızına etki eden faktörler,
- Tepkimeye giren maddelerin türü
- Tepkimeye giren maddelerin derişimi
- Sıcaklık
- Katalizör
- Katılar için temas yüzeyi
- İnert madde eklenmesi
1. Tepkimeye Giren Maddelerin Türü
Tepkimeye giren maddelerin zıt yüklü olması, az bağ kopması ve tepkime denklemindeki maddelerin katsayılarının azalması tepkime hızını artırır. Bu etkileri ünitemizin başında örnekler ile açıklamıştık.
2. Tepkimeye Giren Maddelerin Derişimi
Tepkime verme koşullarını (çarpışma teorisindeki şartlar) sağlayan ve hız denkleminde yer alan maddelerin derişiminin artması etkin çarpışma (ürün verebilen) sayısını artıracağı için tepkime hızı artar. Mekanizmalı tepkimelerde ana denklem ile hız denklemi karıştırılmamalıdır. Yavaş adımdaki maddelerin derişimi artarsa tepkime hızı artar. Hızlı basamaklardaki maddelerin derişimin artması yavaş adımı etkilemediğinden tepkime hızı değişmez. Gaz fazında gerçekleşen tepkimelerde gazların kısmi basınçlarındaki artış, derişimlerini de artıracağından tepkime hızı artar.
3. SICAKLIK
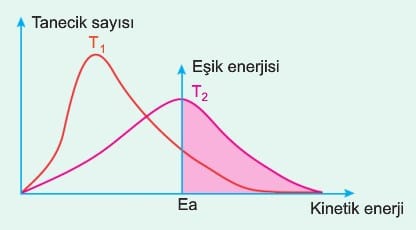
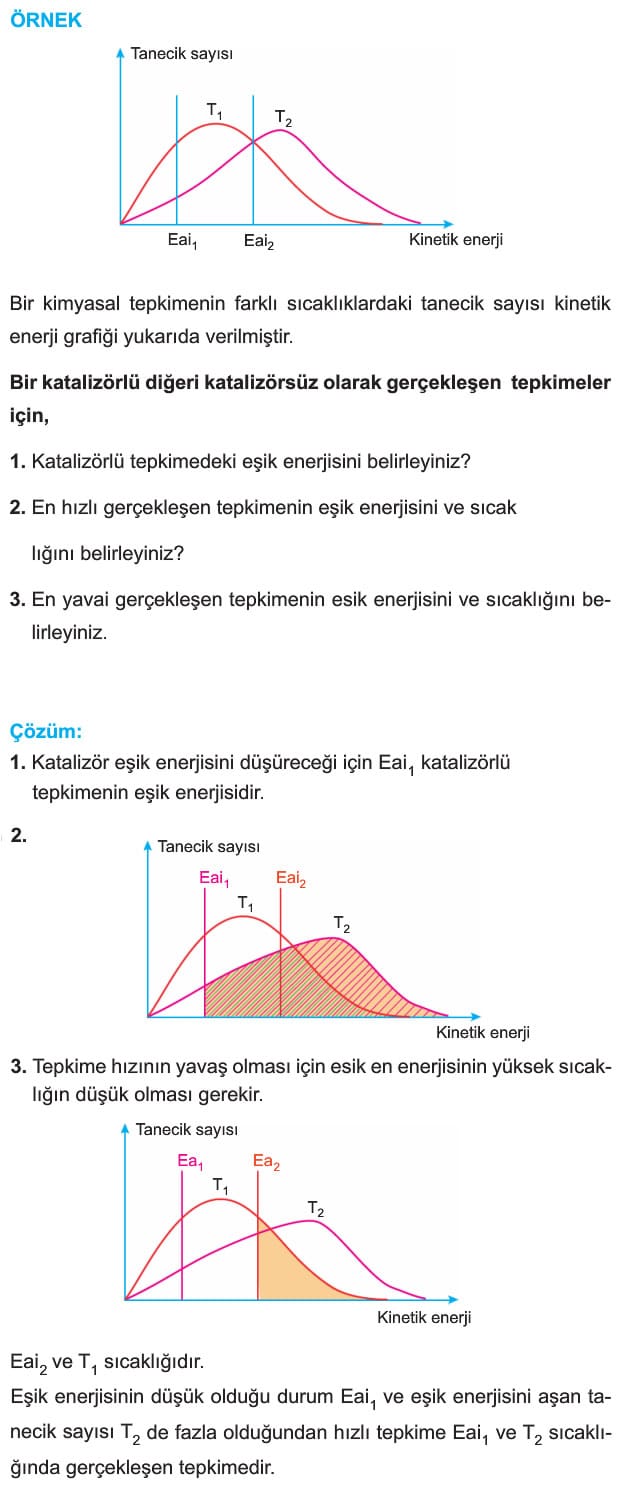
Bir kimyasal tepkimede sıcaklığın artması taneciklerin kinetik enerjisini artırır. Kinetik enerjisinin artması eşik enerjisini geçen tanecik sayısını artırır. Bu durum daha düşük sıcaklığa göre birim zamanda gerçekleşen etkin çarpışma sayısını artırır, bu durum tepkime hızını artırır. Tepkime hızının artması her zaman daha fazla ürün oluşacağı anlamına gelmez. Sadece aktifleşme enerjisini (eşik enerjisini) geçen tanecik sayısını ve birim zamanda harcanan madde miktarını artırır. Örneğin gazlar suda ekzotermik çözünür. Sıcaklık arttıkça toplamda çözünen gaz miktarı azalırken 1 saniyede çözünen madde miktarı artar. T2 sıcaklığında eşik enerjisini geçen tanecik sayısı T, sıcaklığında eşik enerjisini geçen tanecik sayısından fazla olduğu için T2 sıcaklığında tepkime hızı daha fazladır.
4. KATALİZÖR
Bir tepkimeye giren ara basamaklarda değişime uğrayabilen ancak tepkime sonunda değişmeden çıkan ve tepkime hızını artıran maddelere katalizör (pozitif katalizör) denir. Bazı tepkimeler çok hızlı gerçekleşir ve takip edilemez. Bu durumda tepkimeyi yavaşlatmak için kullanılan maddelere inhibitör (negatif katalizör) denir.
Katalizörün Tepkime Hızına Etkisi
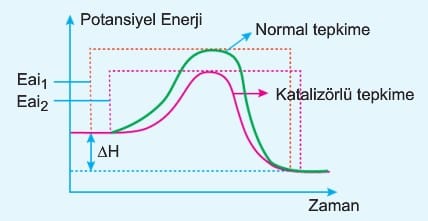
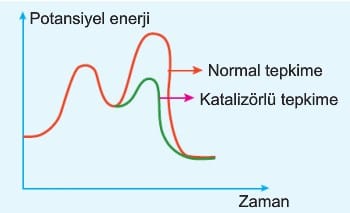
a. Katalizör; Tepkimenin gerçekleşmesi için gereken potansiyel enerjiyi düşünür. Bir başka ifadeyle aktifleşmiş kompleksin daha düşük potansiyel enerji ile gerçekleşmesini sağlar. İleri ve geri aktivasyon enerjisini aynı miktarda düşürür. Bazen iki saatte geçilen Boğaziçi köprüsünü, Marmarayla 4 dakikada aynı mesafeyi kat edebiliyoruz. Katalizörlerde aynı reaksiyonun daha kısa sürede tamamlamasını sağlar.
Diyagramda görüldüğü gibi katalizör reaksiyonun ΔH değerini değiştirmez. Eşik enerjisi ne kadar küçük ise tepkime o derece hızlıdır. Katalizörlü tepkimenin başlaması için daha az enerji gerektiği için (Eai2 < Eai1) tepkime daha hızlı gerçekleşir.
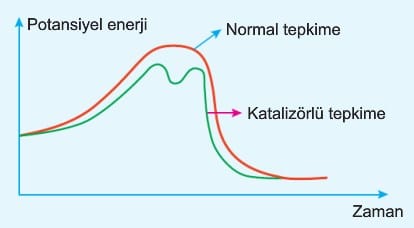
b. Katalizör; Tepkimenin mekanizmasını değiştirebilir. Örneğin tek adımda gerçekleşen tepkime birden fazla adımda gerçekleşebilir.
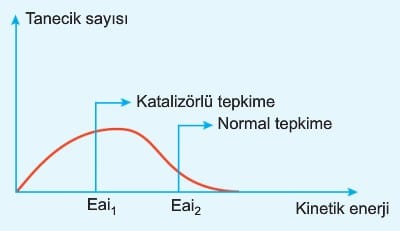
c. Katalizör; Tepkimenin eşik enerjisini düşürür. Bir başka ifadeyle daha düşük kinetik enerjili taneciklerin tepkime vermesini sağlar.
BİLGİ: Katalizör kullanıldığında taneciklerin enerjisi değişmez, tepkime için gerekli olan enerjiler azalır.
Basamaklı tepkimelerde katalizör yavaş basamağa uygulanır.
d. Katalizör: Basamaklı tepkimelerde yavaş adımda kullanılır.
KATILARDA TEMAS YÜZEYİ
Katılarda hız denkleminde yazılmasa da derişimlerinin etkisi hız sabiti içerisindedir. Bu nedenle katıların temas yüzeyinin artması hız sabitinin artmasına neden olur ve tepkime hızı artar.
HACİM VEYA BASINÇ DEĞİŞİMİ
Özellikle gaz fazında gerçekleşen tepkimelerde hacim veya basınç değişimi gazların molaritelerini de değiştirecektir. Bu nedenle tepkime hızı değişir. Basınçla hacim ters orantılı olduğu için basınç iki katına çıkartılıyor ise hacim yarıya indirilmiş ve maddelerin derişimi iki katına çıkmış demektir.
YABANCI MADDE EKLENMESİ (İNERT MADDE)
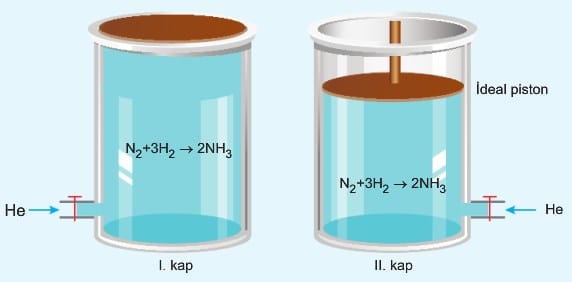
Özellikle gaz fazında gerçekleşen tepkimelerde tepkimeye girmeyen bir madde eklendiğinde kabın hacminde değişim meydana gelebilir, bu durumda tepkime hızı değişir. Bu durumu;
İki kaba da aynı sıcaklıkta He gazı eklendiğinde, I. kapta tepkimeye giren maddelerin hacimleri ve basınçları değişmez. Bu nedenle tepkime hızı değişmez. II. kapta eklenen gaz miktarına bağlı olarak hacim artar. Tepkimeye giren gazlar kaba homojen dağılacağı için, onların da hacmi artar. Tepkimeye giren gazların hacmine bağlı olarak derişimleri azalacağı için tepkime hızı azalır.
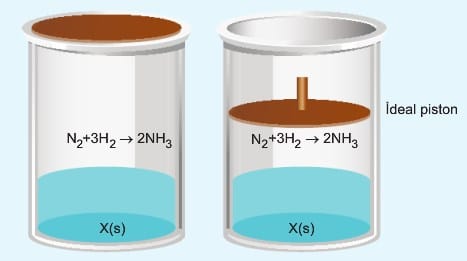
Aynı kaplara tepkime vermeyen sıvı eklenir ise
I. kapta eklenen sıvı yer kaplayacağından gazların hacmi azalır ve derişimleri artar. Bu nedenle de tepkime hızı artar. II. kapta eklenen sıvı hacmi kadar piston yukarı çıkar, gaz hacmi değişmez. Bu nedenle tepkime hızı değişmez.
Bu duruma bir de sulu çözeltilerden örnek verelim:
nötralleşme tepkimesinin gerçekleşeceği kaba su eklenir ise tepkimeye girecek maddelerin derişimi azalacağından tepkime hızı azalır. Kimyasal bir deney yapılırken dışarıdan yapılan etkiler tepkimenin seyrini değiştirebilir.
Çözümlü Örnek Test Soruları
Tepkime Hızını Etkileyen Faktörler
Tepkime hızını etkileyen birçok faktör vardır. Bu faktörler arasında sıcaklık, basınç, reaktanların derişimi, katalizörlerin varlığı ve temas yüzeyi sayılabilir. Bu faktörler, moleküllerin çarpışma sayısını ve enerjisini etkileyerek tepkime hızını değiştirir.
1. Bir kimyasal tepkimenin sıcaklığı artırıldığında tepkime hızı genellikle nasıl değişir?
A) Hız artar, çünkü moleküller daha hızlı hareket eder ve daha sık çarpışır.
B) Hız azalır, çünkü moleküllerin hareketi yavaşlar.
C) Sıcaklık arttıkça hız sabit kalır.
D) Sıcaklığın tepkime hızına etkisi yoktur.
Çözüm: Sıcaklık arttığında, moleküller daha hızlı hareket eder ve çarpışmaların sıklığı ve enerjisi artar, bu da tepkime hızını artırır. Cevap A.
2. Bir tepkimeye katalizör eklenirse, tepkime hızı nasıl etkilenir ve bunun nedeni nedir?
A) Katalizör, tepkimeyi yavaşlatır çünkü reaktanların enerjisini azaltır.
B) Katalizör, tepkime hızını artırır çünkü aktivasyon enerjisini düşürür.
C) Katalizörün tepkime hızına etkisi yoktur.
D) Katalizör, sadece ürünlerin miktarını etkiler.
Çözüm: Katalizör, tepkimenin aktivasyon enerjisini düşürerek tepkime hızını artırır. Cevap B.
3. Hangi durum tepkime hızını artırmaz?
A) Reaktanların derişiminin artırılması
B) Sıcaklığın artırılması
C) Katalizör eklenmesi
D) Reaktanların mol sayısının azaltılması
Çözüm: Reaktanların mol sayısının azaltılması, tepkime hızını artırmaz, aksine hızın azalmasına neden olabilir. Cevap D.
4. Aynı sıcaklıkta iki farklı reaksiyon gözlemleniyor. Reaksiyonlardan biri hızlı, diğeri ise yavaş gerçekleşiyor. Bu durumun sebebi aşağıdakilerden hangisi olabilir?
A) Hızlı tepkimenin aktivasyon enerjisi düşüktür.
B) Yavaş tepkimenin reaktanlarının derişimi daha yüksektir.
C) Hızlı tepkime katalizör kullanıyor olabilir.
D) Her iki tepkimenin hızı da aynıdır, sadece gözlemlenme süreleri farklıdır.
Çözüm: Hızlı tepkimelerin aktivasyon enerjisi daha düşük olabilir ve katalizör kullanımından da hızlanabilir. Cevap A.
5. Bir kimyasal tepkimede basıncın artırılması tepkime hızını nasıl etkiler? (Gaz fazındaki reaksiyonlar için düşününüz.)
A) Basınç artırıldığında tepkime hızı artar çünkü moleküller arasındaki mesafe azalır.
B) Basınç artırıldığında tepkime hızı azalır çünkü moleküller daha yavaş hareket eder.
C) Basınç değişimi tepkime hızını etkilemez.
D) Basınç arttıkça sadece ürünlerin miktarı artar.
Çözüm: Gaz fazındaki reaksiyonlarda basınç artırıldığında moleküller arasındaki mesafe azalır, çarpışma sayısı artar ve tepkime hızı da artar. Cevap A.
6. Bir toz halindeki madde ile aynı maddenin katı bir parçası arasında tepkime hızını etkileyen fark nedir?
A) Toz halindeki madde daha yavaş tepkimeye girer çünkü molekülleri birbirine daha yakındır.
B) Katı madde daha hızlı tepkimeye girer çünkü moleküler yapısı daha düzenlidir.
C) Toz halindeki madde daha hızlı tepkimeye girer çünkü yüzey alanı daha büyüktür.
D) Katı maddenin tepkime hızı toz haline göre daha yüksektir çünkü daha az enerji gerektirir.
Çözüm: Toz halindeki maddelerin yüzey alanı daha büyük olduğu için tepkime hızı daha yüksektir. Yüzey alanı, tepkime hızını artıran önemli bir faktördür. Cevap C.























Fizik, kimya, biyoloji 12. Sınıf dersleri ne zaman yüklenecek?