Periyodik Sistemde Grupların Özellikleri 9. Sınıf Kimya
PERİYODİK SİSTEMLERDE BAZI GRUPLARIN ÖZELLİKLERİ
1 A Grubu — Alkali Metaller
- Li- Na—K—Rb—Cs- Fr
- Son katmanlarında bir elektron vardır.
- Bileşik oluşumuna bir elektron vererek katılırlar. Yani bileşiklerinden hep 14 değerlik alırlar.
- En aktif metallerdir. Bazik karakterlidirler.
- Fr (Fransiyum) bıçakla kesilebilecek kadar yumuşaktır. Aynı zamanda radyoaktiftir.
- Soğuk suyla bile tepkime verirler ve hidrojen gazı açığa çıkartırlar.
- Doğada bileşikler halinde bulunur.
2A Grubu — Toprak Alkali Metaller
- Be-Mg-Ca-Sr-Ba-Ra
- Son katmanlarında iki elektron vardır.
- Bileşik oluşumuna iki elektron vererek katılırlar. Yani bileşiklerinde hep 2: değerlik alırlar.
- Tümü katıdırlar ve bazik karakterlidirler.
- Suyla tepkime vererek hidrojen gazı oluştururlar.
- Alkali metallere göre daha az aktiftirler. (Tepkimeye girme istekleri alkali metallere göre daha azdır)
3A Grubu — Toprak Metalleri
- B-Al -Ge-Sn-Pb
- Son katmanlarında üç elektron vardır.
- Bileşiklerinde 3- değerlik alarak 3 bağ yaparlar.
- İlk üye olan Bor (B) yarı metaldir.
- İkinci üye olan Alüminyum (Al) amfoter özellik gösterir.
- Alüminyumun oksijenli bileşikleri amfoter özellik gösterir.
4A Grubu — Karbon Grubu
- C- Si -Ge- Sn-Pb
- Karbon grubudur.
- C, ametal , Si, Ge, yarı metal , Sn, Pb metaldir.
- Son katmanlarında dört elektron vardır.
- Minimum 4-, maksimum 4+ e kadar yükseltgenme basamağına sahip olabilirler.
5A Grubu — Azot Grubu
- N-P-As-Sb-Bi
- Azot grubudur.
- N, P ametal , As, Sb yarımetal, Bi metaldir.
- Son katmanlarında beş elektron vardır.
- N ve P minimum 3- ve maksimum 5+’e kadar yükseltgenme basamağına sahiptir.
6A Grubu — Oksijen Grubu
- O-S-Se-Te-Po
- Oksijen grubudur.
- O, S, Se ametal, Te, Po yarı metal.
- Son katmanlarında altı elektron vardır.
- Minimum 2- ve maksimum 6+’ya kadar yükseltgenme basamağına sahip olabilirler.
7A Grubu — Halojenler
- F-CI-Br-I—At
- Son katmanlarında yedi elektron vardır.
- Tepkimeye girme isteği en fazla olan ametallerdir.
- Aktifliği en fazla olan ametallerdir.
- Elektron alma isteği en fazla olan ametallerdir.
- At grubun en son üyesi olup yarı metal yarı ametal özelliği gösterir.
- Periyodik sistemdeki elektron alma isteği en fazla olan element F (Flor) olduğundan bileşiklerinde hep 1- değerlik alır.
- Diğer halojenler ise minimum 1-, maksimum 7+ ye kadar değerlik alabilirler. (1-, …… 7+)
- Doğada molekül halde bulunurlar.
(FE2, -GI2, -Br2, -I2, gibi) 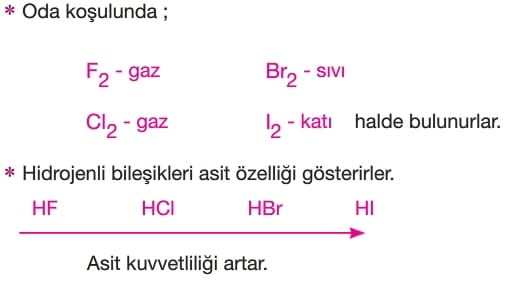
8A Grubu — Soy gazlar (Asal gazlar)
- He – Ne – Ar – Kr – Ke – Rn
- Helyum (He) hariç son katmanlarında sekiz elektron vardır.
- Not: Helyum son katmanında iki elektron bulunduran ve 8A da bulunan elementtir.
- Kararlıdırlar. Tepkimeye girmezler.
- Doğada atomik yapıda bulunurlar ve tümü gaz halde bulunur.
- Renksizdir ve kokusuzdur.
B Grubu Elementleri (Geçiş Metalleri)
- İlk üç periyotta “B” grubu metali yoktur. B grubu metaller dördüncü periyottan itibaren bulunur.
- Tümü metaldir. Çoğu bileşiklerinde birden fazla pozitif değerlik alırlar.
- B grubu metalleri 3B grubu ile başlar, 2B grubu ile biter.
Çözümlü Örnek Test Soruları
1. Aşağıdaki gruplardan hangisinde alkali metaller bulunur?
A) 1A Grubu
B) 2A Grubu
C) 7A Grubu
D) 8A Grubu
Cevap: A) 1A Grubu
Çözüm: 1A Grubu alkali metaller grubudur. Bu grupta lityum (Li), sodyum (Na), potasyum (K) gibi metaller bulunur. Alkali metaller oldukça reaktif olup, suyla şiddetli reaksiyon verirler.
2. Halojenler hangi periyodik grup içinde yer alır?
A) 1A Grubu
B) 2A Grubu
C) 7A Grubu
D) 8A Grubu
Cevap: C) 7A Grubu
Çözüm: Halojenler 7A grubunda yer alır. Bu grupta flor (F), klor (Cl), brom (Br), iyot (I) gibi elementler bulunur. Halojenler oldukça reaktiftir ve genellikle metal olmayan elementlerdir.
3. 2A Grubu elementlerinin genel adı aşağıdakilerden hangisidir?
A) Geçiş metali
B) Alkali toprak metali
C) Halojen
D) Soy gaz
Cevap: B) Alkali toprak metali
Çözüm: 2A Grubu elementleri alkali toprak metaller olarak adlandırılır. Bu grupta berilyum (Be), magnezyum (Mg), kalsiyum (Ca) gibi elementler bulunur. Alkali toprak metaller, alkali metallere göre daha az reaktiftir.
4. Soy gazların kimyasal özellikleri hakkında aşağıdaki ifadelerden hangisi doğrudur?
A) Çok kolay tepkime verirler.
B) Elektron alışverişine çok yatkındırlar.
C) Kararlı bir yapıya sahiptirler.
D) 7A grubunda yer alırlar.
Cevap: C) Kararlı bir yapıya sahiptirler.
Çözüm: Soy gazlar (8A Grubu) kararlı bir elektron dizilimine sahiptir ve genellikle kimyasal tepkimeye girmezler. Helyum (He), neon (Ne), argon (Ar) gibi elementler bu grupta yer alır.
5. Periyodik sistemde 1A Grubu elementleri ile 7A Grubu elementlerinin tepkimesinden oluşabilecek bir bileşik aşağıdakilerden hangisidir?
A) HCl
B) NaCl
C) MgO
D) CO₂
Cevap: B) NaCl
Çözüm: 1A Grubu elementlerinden biri olan sodyum (Na) ile 7A Grubu elementlerinden biri olan klor (Cl) birleşerek NaCl (sodyum klorür) bileşiğini oluşturur. Bu tür bileşikler iyonik bağ içerir.
6. Aşağıdaki özelliklerden hangisi geçiş metallerine aittir?
A) Yüksek erime ve kaynama noktalarına sahiptir.
B) Elektrik ve ısıyı iyi iletmezler.
C) Sadece ametal özellik gösterirler.
D) Soy gaz özelliklerine sahiptirler.
Cevap: A) Yüksek erime ve kaynama noktalarına sahiptir.
Çözüm: Geçiş metalleri genellikle sert, yüksek erime ve kaynama noktalarına sahip elementlerdir. Ayrıca elektrik ve ısıyı iyi iletirler. Bu özellikleri nedeniyle endüstride yaygın olarak kullanılırlar.
iyiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiii
hemde nasıl