Periyodik Özellikler 11.Sınıf Kimya
Periyodik Özellikler
Atom Yarıçapı
Özdeş iki atom çekirdeği arasındaki uzaklığın yarısına atom yarıçapı denir. Atom yarıçapı, atom çekirdeği ile en dış yörünge arasındaki uzaklık gibi düşünülebilir. Atom yarıçapları karşılaştırılırken önce yörünge sayısına, daha sonra proton sayısına bakılır.
» Yörünge sayısı fazla olan atomun yarıçapı daha büyük olur.
» Yörüngeler eşit ise proton sayısı az olan atomun yarıçapı daha büyüktür.
Örneğin 19K, 7N, 3Li ve 3He atomlarının yarıçaplarını karşılaştıralım.
Bu atomların katman dizilimlerine göre yörünge sayıları aşağıdaki gibi olur.

Yörüngesi fazla olan atomun yarıçapı büyük olacağından K’nin yarıçapı en büyük, He’nin ise en küçüktür. Li ve N’nin yörüngeleri eşit olduğuna göre, protonu az olan Li’nin yarıçapı N’ninkinden daha büyüktür.
Buna göre, atom yarıçapları K > Li > N > He şeklinde olur.
Atom elektron aldığında çapı büyür, verdiğinde küçülür.
» Bir atom ve bu atomun iyonlarının yarıçapları arasında, anyon > nötr atom > katyon ilişkisi geçerlidir. Örneğin P5+, P ve P3- taneciklerinin yarıçaplarını karşılaştıralım. Bu taneciklerin katman dizilimi aşağıdaki gibidir.
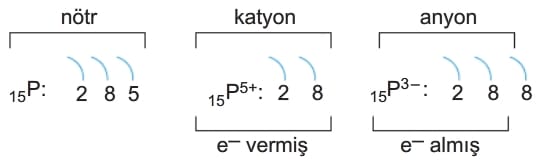
Bu taneciklerden P3- elektron aldığından çapı büyük, P5+ elektron verdiğinden çapı en küçüktür. Buna göre, taneciklerin yarıçapları P3- >P > P5+ şeklinde olur.
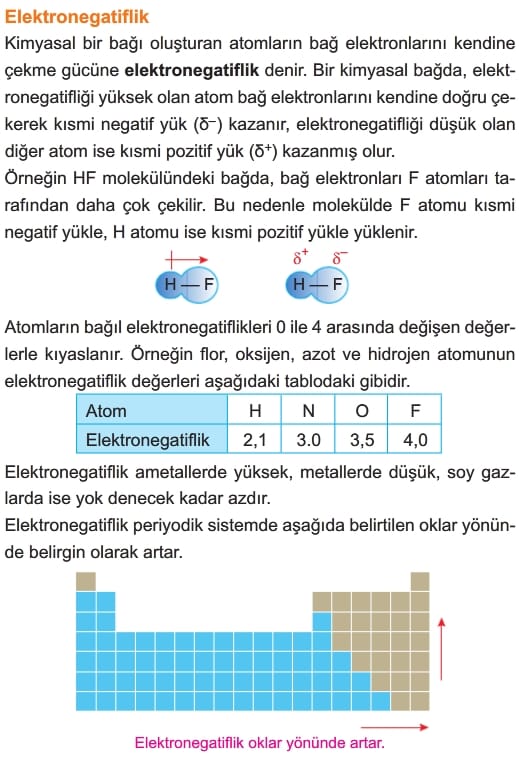
Atom yarıçapı periyodik sistemde aynı grupta yukarıdan aşağıya, aynı periyotta sağdan sola doğru aşağıda belirtilen oklar yönünde
belirgin olarak artar.

İyonlaşma Enerjisi
Gaz hâlindeki bir atom veya iyondan bir elektron koparmak için gerekli enerjiye iyonlaşma enerjisi denir. İyonlaşma enerjileri aşağıdaki denklemle ifade edilir.
![]()
Bir atomun iyonlaşma enerjisi büyük ise o atomdan elektron koparmak zordur. İyonlaşma enerjileri bir periyotta aşağıdaki grafikteki gibi değişir.
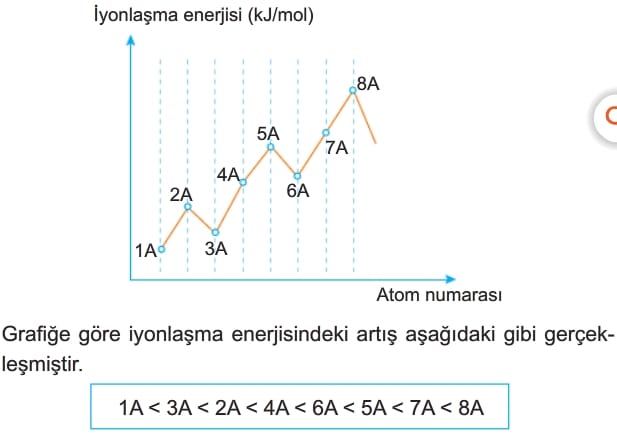
Bu sıralamada 2A, 5A gruplarındaki iyonlaşma enerjilerinin kendilerinden sonra gelen gruplardaki atomlardan yüksek olması kararlılıktan kaynaklanır.
İyonlaşma enerjileri karşılaştırılırken önce grup kararlılığına, daha sonra çapa bakılır.
» Grup kararlılığı yüksek olan atomun iyonlaşma enerjisi daha büyük olur.
» Grup kararlılığı aynı ise yarıçapı küçük olan atomun iyonlaşma enerjisi daha büyüktür.
Örneğin 7Ne, 8O ve 16S element atomlarının iyonlaşma enerjilerini karşılaştıralım.
Bu atomların katman elektron dizilimleri ve grupları aşağıdaki gibi olur.
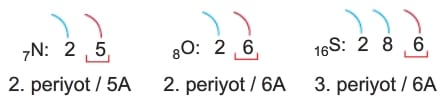
Bu elementlerin grup kararlılık sırası 5A > 6A şeklindedir.
Ayrıca 6A grubu elementi O’nun yarıçapı S’den daha küçüktür. İyonlaşma enerjisi kararlılıkla doğru, çap ile ters orantılı olduğuna göre sıralama N > O > S şeklinde olmalıdır.
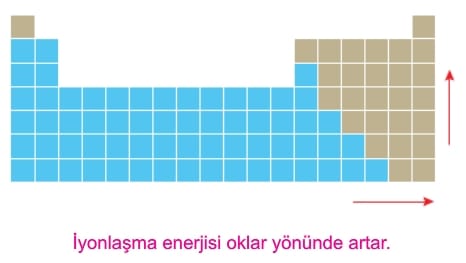
İyonlaşma enerjilerinin periyodik sistemdeki artış yönü aşağıdaki gibidir.
Metalik ve Ametalik Özellik
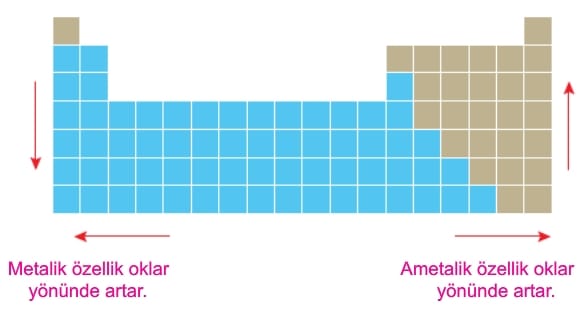
Bir atomun elektron verme eğilimine metalik özellik, elektron alma eğilimine ise ametalik özellik denir.
Periyodik sistemde metalik özellik sağdan sola ve yukarıdan aşağıya doğru artarak 1A grubunda en yüksek değerlere ulaşır. Ametalik özellik ise soldan sağa ve aşağıdan yukarıya doğru artarak 7A grubunda en yüksek değerlere ulaşır.
Çözümlü Örnek Test Soruları
Elementlerin periyodik tablodaki yerlerine göre belirli özellikler gösterir. Atom yarıçapı, iyonlaşma enerjisi ve elektronegatiflik gibi özellikler bu düzenlemelerle ilgilidir.
1. Aşağıdaki elementlerden hangisi en büyük atom yarıçapına sahiptir?
A) Lityum
B) Berilyum
C) Bor
D) Karbon
Çözüm: Aynı periyotta atom numarası arttıkça atom yarıçapı küçülür. Bu yüzden Lityum en büyük atom yarıçapına sahiptir. Cevap A.
2. Aşağıdakilerden hangisi bir elementin iyonlaşma enerjisinin artmasına neden olur?
A) Atom numarasının artması
B) Atom yarıçapının küçülmesi
C) Periyot numarasının artması
D) Nötron sayısının artması
Çözüm: Atom yarıçapı küçüldükçe iyonlaşma enerjisi artar, çünkü elektronlar çekirdek tarafından daha güçlü çekilir. Cevap B.
3. Aşağıdaki elementlerden hangisi en yüksek elektronegatiflik değerine sahiptir?
A) Flor
B) Oksijen
C) Azot
D) Karbon
Çözüm: Flor, periyodik tabloda en yüksek elektronegatiflik değerine sahip elementtir. Cevap A.
4. Aşağıdaki elementlerden hangisinin ilk iyonlaşma enerjisi en düşüktür?
A) Lityum
B) Sodyum
C) Potasyum
D) Rubidyum
Çözüm: Potasyum (K), alkali metallerden olup atom yarıçapı büyüktür ve ilk iyonlaşma enerjisi daha düşüktür. Cevap C.
5. Aşağıdaki elementlerden hangisi metalik özellik bakımından en kuvvetlidir?
A) Magnezyum
B) Alüminyum
C) Kalsiyum
D) Sodyum
Çözüm: Periyodik tabloda metalik özellik sola ve aşağıya doğru artar. Kalsiyum, bu elementler arasında metalik özellik bakımından en güçlü olanıdır. Cevap C.
6. Aşağıdaki elementlerden hangisi periyodik tabloda sağa doğru gidildikçe azalır?
A) Atom yarıçapı
B) İyonlaşma enerjisi
C) Elektronegatiflik
D) Proton sayısı
Çözüm: Periyodik tabloda sağa doğru gidildikçe atom yarıçapı azalır. Cevap A.
Konu anlatımlı kitap almaya gerek yok çok süper anlatılmış. Teşekkürler.