İyonik Bağ 9.Sınıf Kimya
9. Sınıf İyonik Bağ Testleri
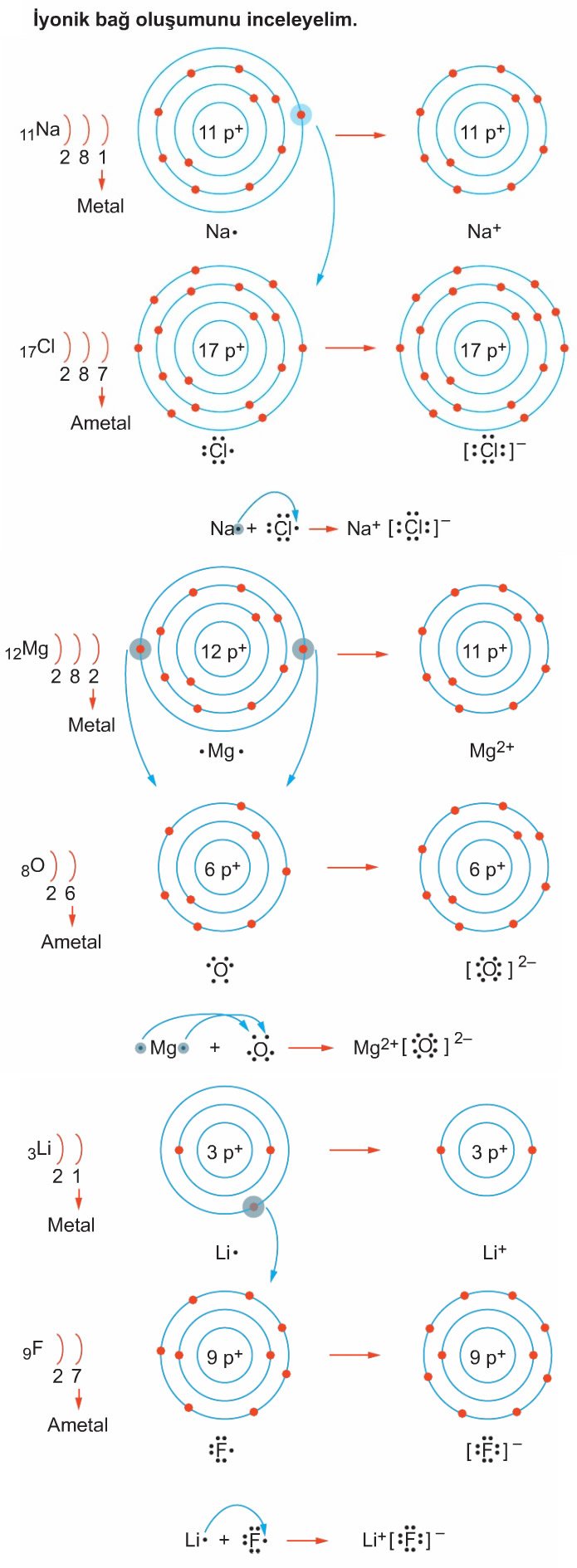
İyonik bağı oluşturan tanecikler, ilk önce iyonları oluşturur, oluşan bu iyonlar arasındaki elektrostatik çekim kuvveti ile bağ meydana gelir. Metal atomları elektron vermeye, ametal atomları ise elektron almaya daha yatkındır. Metal atomları elektron vererek + (pozitif), ametal atomları ise elektron alarak – (negatif) yüklenirler. Bu elektron alışverişlerinde tanecikler daha kararlı hale gelmeyi amaçlarlar. Oluşan bu zıt yüklü iyonlar birbirlerini çekerek İyonik bağı oluşturur.
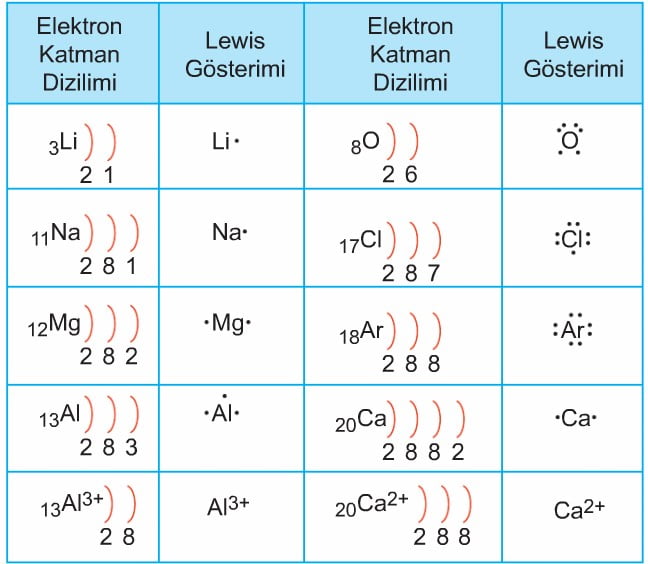
Lewis Elektron Nokta Yapısı
Lewis, bir elementin veya iyonun elektron katman diziliminde son yörüngede bulunan elektronların (değerlik elektronları) elementin simgesi etrafında nokta koyulması ile gösterimini açıklamıştır.
Bazı atom ve iyonların Lewis (elektron nokta yapısı) gösterimi
İyonik bağı oluşturan zıt yüklü iyonlardır. Bu iyonların ilk olarak bir araya gelmesiyle oluşan küçük birimler daha sonra birleşerek çeşitli tiplerde düzenli örgü yapıları oluştururlar. İyonik bileşiklerin çoğunda anyon çapı katyon çapından daha büyük olduğundan, anyonların aralarındaki boşluklara katyonlar girerek örgü oluşur.
Düzenli örgülerin oluşturduğu kristal yapılarda her iyon belirli sayıda komşu ve zıt yüklü iyonun çekimi etkisindedir. Örneğin NaCl’de her Na+ iyonu 6 Cl– iyonu tarafından, her Cl– iyonu da 6 Na+ iyonu tarafından sarılır. Bu durumda meydana gelen birimlere birim hücre denir. Birim hücrelerin bir araya gelmesiyle kristal yapı oluşur.
İyonik örgülerle meydana gelen yapılar arasındaki etkileşim türü güçlü etkileşimdir. Bu nedenle iyonik bileşiklerin sertlik, erime ve kaynama sıcaklığı gibi bazı fiziksel özelliklerini ifade eden değerler yüksek olur. İyonik bağlı bileşiklerin erime, kaynama sıcaklıkları ve sertliklerinin farklı olma nedeni, iyonik bağın sağlamlığı ile ilgilidir.
İyonik bağı oluşturan iyonların yüklerinin büyük olması iyonik bağın daha sağlam olmasını sağlar. Aynı zamanda iyonik bağı oluşturan iyonların aralarındaki mesafe (yarıçap) ne kadar büyükse iyonik bağın sağlamlığı o kadar azalır. Yani iyonik bağın sağlamlığı iyonların yükleri ile doğru, çapları ile ters orantılıdır. CaO ve MgO bileşiklerinden hangisinde iyonik bağın daha sağlam olduğunu inceleyelim.
İyonik Bağlı Bileşiklerin Özellikleri
- İyonik bileşikler, kristal yapıda olur ve tanecikleri molekül değildir.
- Zıt yüklü iyonlar arasındaki çekim kuvveti, bu bileşiklerin sertlik, erime noktası ve suda çözünme gibi özelliklerini belirler.
- İyonik katılar kırılgandır; dışarıdan darbe aldıklarında, aynı yüklü iyonlar yan yana gelir ve birbirlerini iterek katının kırılmasına neden olur. Bu yüzden şekil verilemez.
- Çoğu iyonik katı, suda çözünerek iyonlarına ayrışır. Ancak bazıları suda çok az çözünür veya çözünmez.
- İyonik bileşiklerin sulu çözeltileri veya sıvı halleri elektrik iletir çünkü içinde serbestçe hareket edebilen iyonlar bulunur.
- Yüksek erime ve kaynama noktalarına sahiptirler, çünkü iyonlar arasındaki bağlar çok kuvvetlidir.
İyonik Bileşiklerin Sistematik Adlandırılması
Metal ve ametal elementlerin bir araya gelmesiyle oluşan bileşiklere iyonik bileşikler denir. Bu tür bileşikleri doğru bir şekilde adlandırabilmek için, bileşiği meydana getiren iyonların adlarını ve gerekirse yüklerini bilmek önemlidir.
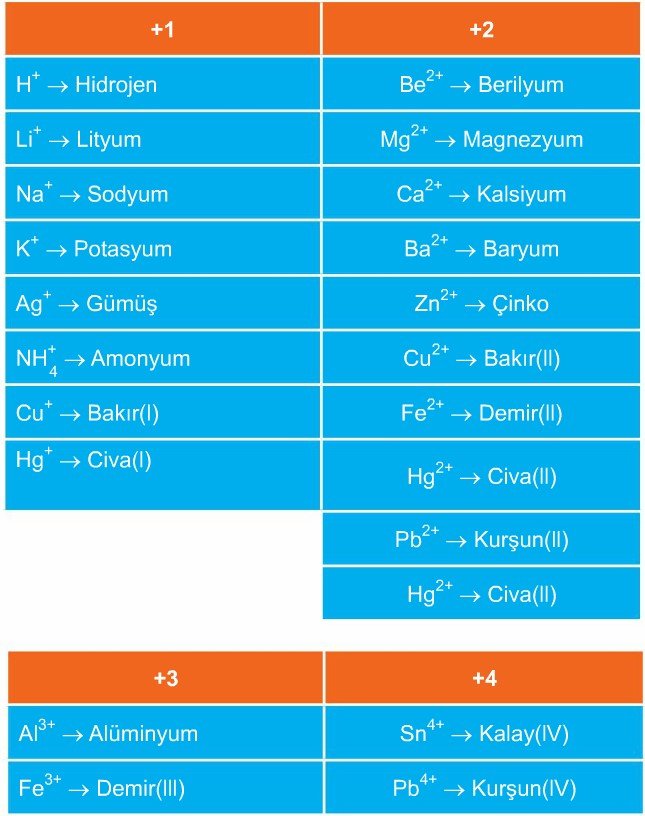
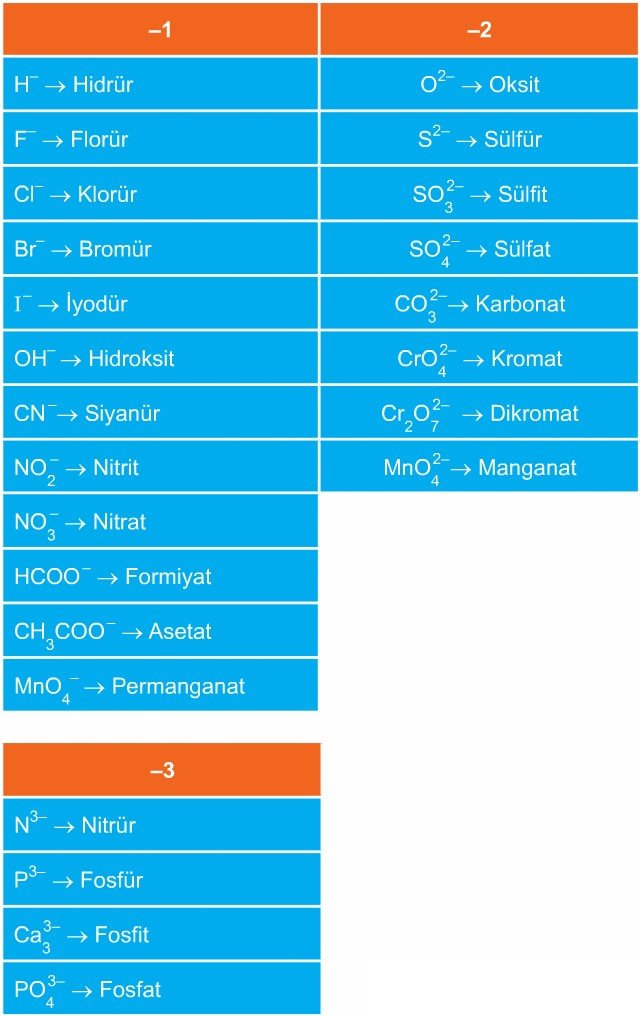
Aşağıda, yaygın olarak kullanılan bazı iyonların sembolleri, yükleri ve adları yer almaktadır.
Katyonlar
Anyonlar
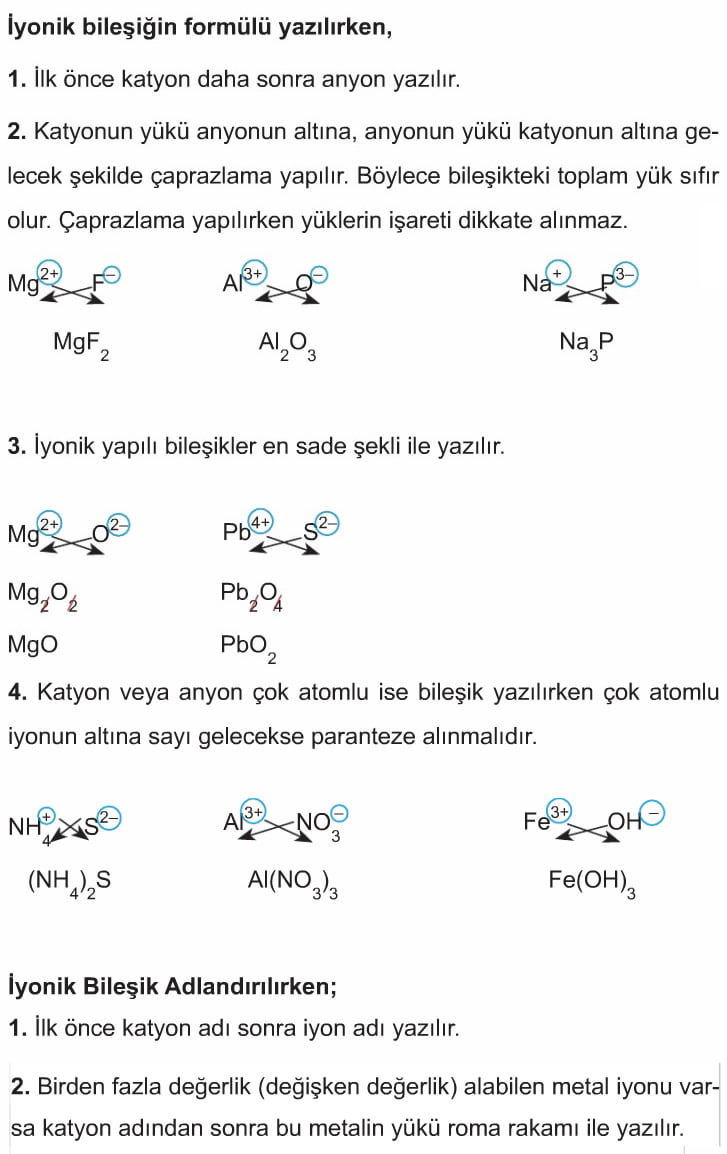
İyonik Bileşiklerin Formüllerinin Yazılması ve Adlandırılması
Çözümlü Örnek Sorular
Soru 1:
İyonik bağ nasıl oluşur?
A) İki atomun elektronlarını ortaklaşa kullanmasıyla
B) Bir atomun elektron alması ve diğerinin vermesiyle
C) Proton alışverişi ile
D) İki atomun nötronlarını paylaşmasıyla
Çözüm:
İyonik bağ, bir atomun elektron vermesi ve diğer atomun elektron alması sonucunda oluşur. Elektron alışverişi ile pozitif ve negatif yüklü iyonlar meydana gelir ve bu iyonlar arasındaki çekim kuvveti iyonik bağı oluşturur.
Sonuç: B) Bir atomun elektron alması ve diğerinin vermesiyle
Soru 2:
Aşağıdaki bileşiklerden hangisi iyonik bağ içerir?
A) H₂O
B) NaCl
C) CH₄
D) NH₃
Çözüm:
NaCl (sodyum klorür) bileşiği, sodyumun elektron verip pozitif iyon, klorun ise elektron alıp negatif iyon oluşturması sonucu meydana gelir ve iyonik bağ içerir.
Sonuç: B) NaCl
Soru 3:
İyonik bağlar hangi elementler arasında oluşur?
A) İki ametal arasında
B) Metal ve ametal arasında
C) İki metal arasında
D) İki soy gaz arasında
Çözüm:
İyonik bağlar genellikle bir metal ile bir ametal arasında oluşur. Metal elektron verir ve ametal elektron alarak iyonik bağı oluştururlar.
Sonuç: B) Metal ve ametal arasında
Soru 4:
Aşağıdaki bileşiklerden hangisinin iyonik bağ içerme olasılığı en yüksektir?
A) CO₂
B) KCl
C) H₂
D) N₂
Çözüm:
KCl (potasyum klorür), bir metal olan potasyumun ve bir ametal olan klorun iyonik bağ yaparak oluşturduğu bileşiktir.
Sonuç: B) KCl
Soru 5:
CaCl₂ bileşiğinde kalsiyum (Ca) atomu kaç elektron verir?
A) 1
B) 2
C) 3
D) 4
Çözüm:
CaCl₂ bileşiğinde kalsiyum atomu iki elektron vererek +2 yüklü iyon oluşturur ve her klor atomu bir elektron alır.
Sonuç: B) 2



Allah razı olsun yazandan işime yaradı.
Çok güzel anlatılmış
Projemi mükemmel şekilde yardımcı oldu teşekkürler başarılarınızın devamını dilerim
varya bütüngün çalıştım ama deydi
çok güzel anlatmışsınız
Çok teşekkür ederim sizee❤❤
Cok isime yaradi tesekkur ederim
Çok sağolunnnnnn projeme yardımcı oldu. tşklr 🙂
Çok iyisiniz böyle devam