Yükseltgenme Basamakları 11.Sınıf Kimya
YÜKSELTGENME BASAMAKLARI
İYON YÜKÜ VE YÜKSELTGENME BASAMAĞI
İyonik bileşikler elektron alışverişi ile oluşur. Bu nedenle bileşiği oluşturan atomlar net olarak “+” ya da “—” yüke sahiptir. Buna iyon yükü denir.
Kovalent bileşikler, elektron ortaklaşmasıyla oluştuğundan, iyonik bileşikler gibi net iyon yüklerine sahip değildir. Bu nedenle bu bileşiklerdeki atomların yüklerine yükseltgenme basamağı denir. Atomların yükseltgenme basamakları ile son katmanındaki elektron sayıları arasında ilişki vardır.
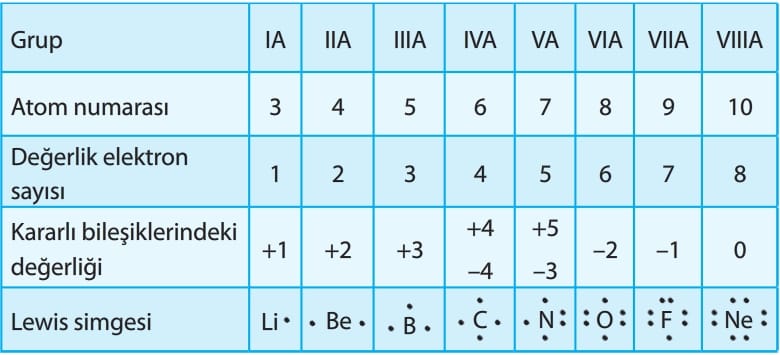
> Hidrojen ametallerle yaptığı bileşiklerde “+1” metallerle yaptığı bileşiklerde “-1” yükseltgenme basamağına sahiptir. Hidrojenin -1 yüklü olduğu bileşiklere hidrür denir.
> Oksijen genellikle“-2” yükseltgenme basamağına sahiptir. H2O2, CaO2 gibi peroksitlerde —1, KO2 gibi süper oksitlerde ise -1/2 yükseltgenme basamağına sahiptir. Oksijenin flor (9F) ile yaptığı OF2 bileşiğindeki yükseltgenme basamağı +2 dir.
> 1A grubu elementleri “+1”, 2A grubu elementleri “+2”, 3A grubu elementleri ise “+3” yükseltgenme basamağına sahiptir.
> 7A grubu elementlerinden flor (F) bütün bileşiklerinde “-1” yükseltgenme basamağına sahip iken grubun diğer üyelerinden 17Cl “-1” ile “+7” arasında 35Br “—1” ile “+5” arasında,53l ise “-1” ile “+7” arasında değişen yükseltgenme basamağına sahiptir.
FARKLI YÜKSELTGENME BASAMAKLARI
d blokundaki metallerin pek çoğu birden fazla yükseltgenme basamağına sahiptir. Bir elementin birden fazla yükseltgenme basamağına sahip olması değerlik elektronlarının dağılımı ve atom çapı ile ilgilidir.
![]()
Titan, 4s ve 3d orbitallerindeki elektronlarını vererek “+2” ve “+4” yükseltgenme basamağında bulunabilir.
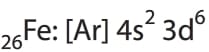
Demir,4s orbitalindeki 2 elektronunu vererek “+2”yükseltgenme basamağına ya da 4s deki 2 elektronuyla 3d deki 6 elektrondan birini daha vererek “+3” yükseltgenme basamağına sahip olabilir.
Çözümlü Örnek Test Soruları
Yükseltgenme basamağı, elementlerin kimyasal reaksiyonlar sırasında elektron alıp verme eğilimlerini belirler. Bu, özellikle redoks tepkimelerinde önemlidir.
1. Aşağıdaki elementlerden hangisinin yükseltgenme basamağı her zaman -1’dir?
A) Oksijen
B) Hidrojen
C) Flor
D) Sodyum
Çözüm: Flor (F) her zaman -1 yükseltgenme basamağına sahiptir. Cevap C.
2. Aşağıdaki bileşiklerden hangisinde oksijenin yükseltgenme basamağı +2’dir?
A) O₂
B) H₂O
C) H₂O₂
D) OF₂
Çözüm: OF₂ bileşiğinde oksijenin yükseltgenme basamağı +2’dir. Cevap D.
3. Aşağıdaki bileşiklerden hangisinde hidrojenin yükseltgenme basamağı -1’dir?
A) NaH
B) H₂O
C) HCl
D) CH₄
Çözüm: NaH bileşiğinde hidrojen -1 yükseltgenme basamağına sahiptir. Cevap A.
4. Aşağıdaki elementlerden hangisi bileşiklerinde pozitif yükseltgenme basamağına sahip olabilir?
A) Flor
B) Klor
C) Oksijen
D) Neon
Çözüm: Klor (Cl) bileşiklerinde pozitif yükseltgenme basamağına sahip olabilir. Cevap B.
5. SO₄²⁻ iyonundaki kükürt atomunun yükseltgenme basamağı nedir?
A) +4
B) +6
C) -2
D) 0
Çözüm: SO₄²⁻ iyonunda kükürtün yükseltgenme basamağı +6’dır. Cevap B.
6. Hangi elementin bileşiklerinde yükseltgenme basamağı genellikle +1’dir?
A) Hidrojen
B) Oksijen
C) Flor
D) Azot
Çözüm: Hidrojen (H) genellikle +1 yükseltgenme basamağına sahiptir. Cevap A.