Suyun Otoiyonizasyonu 11. sınıf kimya
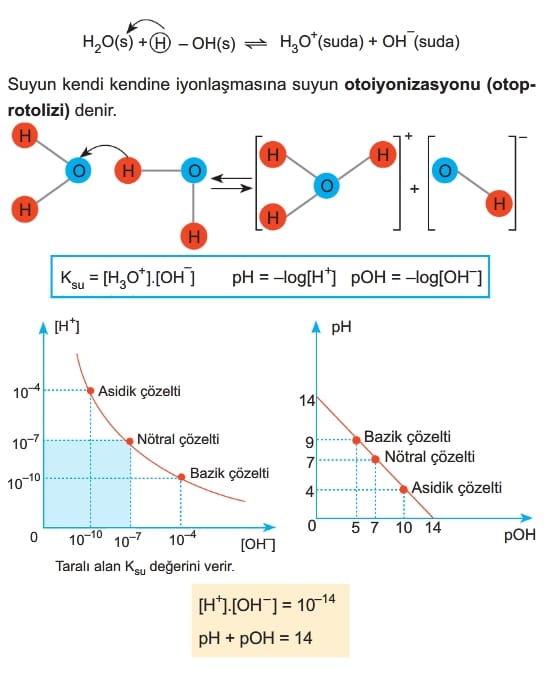
SUYUN OTOİYONİZASYONU İLE ASİT BAZLARDA pH VE pOH KAVRAMLARI
Metal – Asit Tepkimesi
Aktif metaller asitler ile tepkime verdiğinde asitteki H+ iyonunu indirgeyerek H2 gazına dönüştürürken kendi de yükseltgenerek asitteki anyonla birleşerek tuz oluşturur. Verilen ve alınan elektron sayısı eşit olacağı için metalin verdiği elektron sayısının yarısı kadar H2 gazı oluşur.
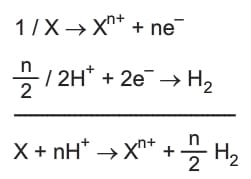
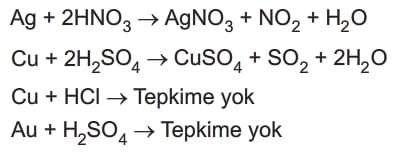
Soymetal – Asit Tepkimesi
Bu metaller, altın(Au), platin (Pt), gümüş (Ag), bakır(Cu) ve cıva(Hg) dir.
Bu metallerden altın(Au) ve platin(Pt) tam soymetallerdir. Hiçbir asit ile tepkime vermez.

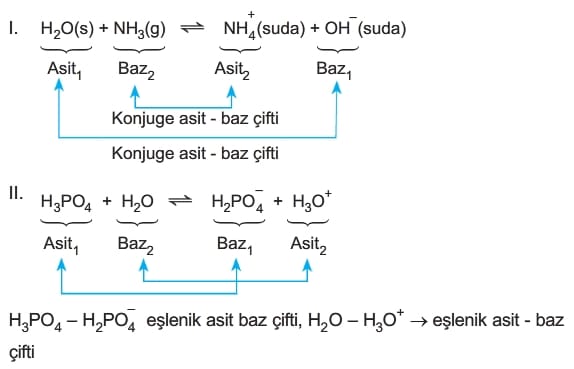
Asit ve Bazların Tanımları
Arrhenius Asit – Baz Tanımı
Asit ve bazlar ile ilgili ilk çalışmayı yapan İsveçli kimyacı S. Arrhenius’a göre, içerisinde H+ iyonu bulunan ve suda çözündüğünde çözeltiye H+ iyonu veren maddeler asit, içerisinde OH iyonu bulunan ve suda çözündüğünde OH– iyonu veren maddeler bazdır.
Bronsted – Lowry Asit- Baz Tanımı
Suda çözündüğünde proton veren (H+ derişimini artıran) maddelere asit denir.
Suda çözündüğünde proton alan (H+ derişimini azaltan) maddelere baz denir.
Kuvvetli Asit – Bazlarda pH ve pOH Kavramları
Suda çözündüğünde tamamen iyonlaşan asit – bazlara kuvvetli asit veya baz denir.
Zayıf Asit – Bazların İyonlaşma Oranı ve Denge Sabitleri
Zayıf asit ve bazlarda suda tamamen çözünür; ancak tamamı iyona dönüşmüyor ise bu maddelere zayıf asit veya baz denir.
Öyle ise HF çözeltisinde bir denge söz konusudur.