Mol Hesaplamaları 10. Sınıf Kimya
“Mol” kavramı kimyada işlem kolaylığı sağlayan ve belirli bir miktarın oluşturduğu topluluğu belirten bir birimdir.
* Atom, iyon, molekül, elektron, proton, nötron gibi taneciklerin adedini belirtmek için mol birimi kullanılır.
Mol, 12 gram İ2C izotopunun içerdiği atom sayısı kadar tanecik içeren madde miktarıdır.

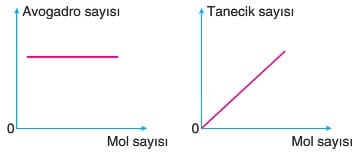
* 6,02 x 1023 tane tanecik 1 mol’dür.
1 düzine – 12 tane
1 deste – 10 tane
1 mol – 6,02 x 1023 tane
Mol sayısı “n” sembolü ile gösterilir.
6,02 x 1023 sayısı “Avogadro sayısı” olarak bilinir ve NA sembolü ile gösterilir.
1 molde Avogadro sayısı kadar tanecik (atom, molekül vb.) vardır.
BİR YORUM YAZIN
ZİYARETÇİ YORUMLARI - 0 YORUM