Asitler ve Bazlar 8.Sınıf Fen
1. Asitler
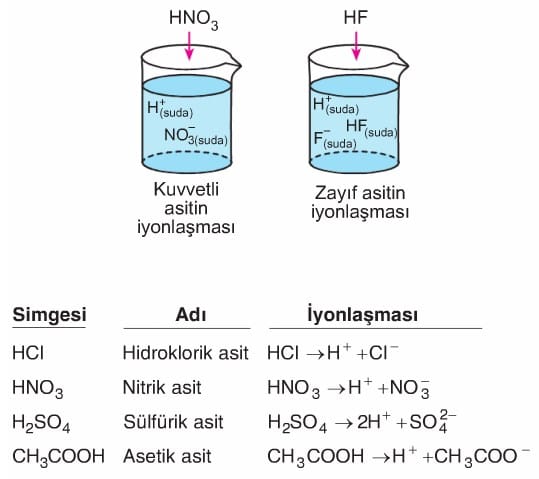
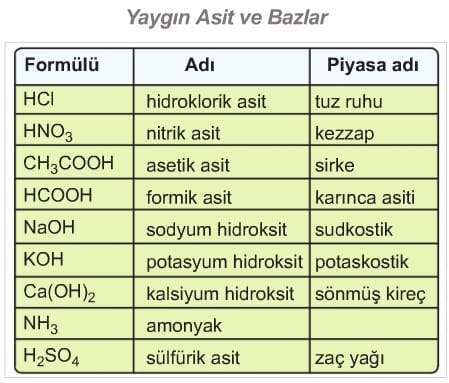
Suda çözündüklerinde H+ iyonu oluşturabilen maddelere asit denir. Buradan asitlerin suda iyonlaşabilen maddeler olduğu sonucuna da ulaşılabilir. Günlük yaşantımızda asitlerin yeri çok önemlidir. Motorlu araçların akülerinde kullanılan sülfürik asit, temizlikte kullanılan tuz ruhu (hidroklorik asit), halk arasında kezzap olarak bilinen nitrik asit, sirkeye ekşi tadını veren asetik asit, Iimona ekşi tadını veren sitrik asit, aspirindeki asetil salisilik asit, gazozdaki karbonik asit örnek olarak verilebilir.
Yukarıda verilen örneklerden bazıları çok tehlikeli yakıcı ve tahriş edici, bazıları ise çok faydalı olan maddelerdir. Buradan genel olarak asitlerin iki gruba ayrıldığı düşünülebilir.
Kuvvetli asit: Suda çözündüğünde tamamen iyonlaşabilen asitlerdir.
Zayıf asit: Suda çözündüklerinde az iyonlaşabilen asitlerdir.
- Asitlerin Özellikleri
- Sulu çözeltileri elektrik akımını iletir.
- Turnusol kağıdının rengini kırmızıya çevirirler.
- Asitlerin tatları ekşidir.
- Asitler yakıcı ve tahriş edicidir.
- Asitler bazlarla birleşerek tuz ve su oluştururlar. Bu olaya nötürleşme (nötralleşme) denir.

- Asitlerin metallerle reaksiyonunda hidrojen gazı açığa çıkar. Bu nedenle asitler metal kaplarda saklanmazlar.
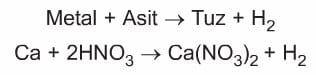
Ancak asitler Cu, Hg, Ag, Pt ve Au metalleri ile H2 gazı oluşturamazlar.
- Fenolftalein damlatıldığında renk değiştirmezler.
2. Bazlar
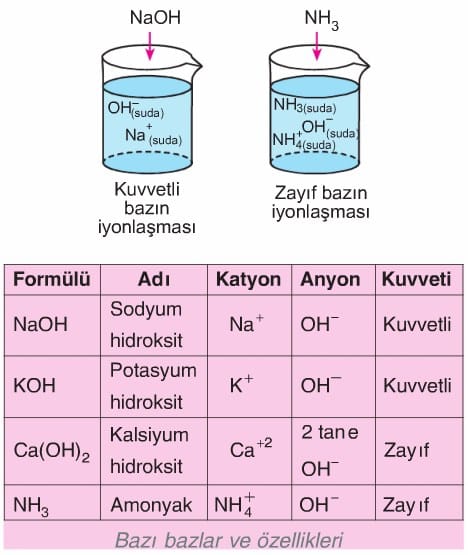
Suda çözündüklerinde OH’ iyonu oluşturabilen maddelere baz denir. Buradan bazların suda iyonlaşabilen maddeler olduğu sonucuna ulaşılabilir. Günlük yaşantımızda bazların da yeri çok önemlidir. Çamaşır sodası, sabun, diş macunu, deterjanlar, amonyaklı temizlik maddeleri ve bazı ilaçlar bazik maddelere örnek olarak verilebilir.
Sabun yapımında kullanılan kostik (sodyum hidroksit) ve potasyum hidroksit, binaların badanasında kullanılan kireçli su (kalsiyum hidroksit) önemli bazlardır.
Kuvvetli baz: Suda çözündüğünde tamamen iyonlaşabilen bazlardır.
Zayıf baz: Suda çözündüklerinde az iyonlaşabilen bazlardır.
Bazların Özellikleri
- Sulu çözeltilerinde iyon oluşturduklarından, sulu çözeltileri elektrik akımını iletir.
- Tatları acımsıdır.
- Turnusol kağıdının rengini kırmızıdan maviye dönüştürürler.
- Sadece amfoter metaller ile (Zn, Al, Pb, Sn, Cr) tepkimeye girerek hidrojen gazı (H2) açığa çıkarırlar.
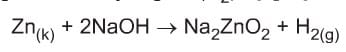
- Elle tutulduklarında kayganlık hissi verirler.
- Asitlerle nötürleşme (nötralleşme) reaksiyonu verirler.
- Fenolftalein damlatıldığında renk değiştirirler.
GÜNLÜK YAŞAMDA ASİT VE BAZLAR
- Limonun ekşi tadını yapısındaki sitrik asit (limon asidi) verir.
- Salatalarda kullandığımız sirke, bir asetik asit (sirke asidi) çözeltisidir.
- Sorbik asit, küf ve mayaların gelişmesine engel olur. Bu nedenle yiyeceklerde antimikrobik koruyucu olarak kullanılır.
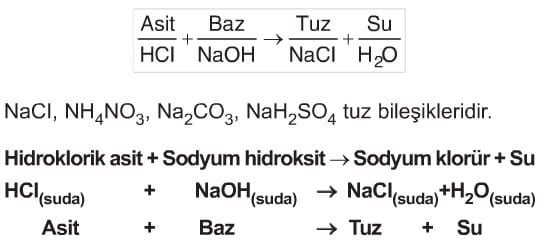
Tuzlar
Asit ve baz bileşikleri arasında gerçekleşen reaksiyona nötürleşme (nötralleşme) reaksiyonu denir. Nötürleşme reaksiyonu sonucu tuz ve su bileşikleri elde edilir.
Tuzların Özellikleri
- İyon yapılı bileşiklerdir.
- Katı hâlde elektriği iletmezler, sulu çözeltileri ve sıvı halleri elektrik akımını iletir.
- Suda iyonlarına ayrışırlar.
- Nötr özellik taşıdıklarından turnusol kâğıdına etki etmezler.
Asit ve bazlarla çalışırken uymamız gereken kurallar şunlardır;
- Asitler ve bazlar, yakından koklanmamalı ve tatlarına bakılmamalıdır.
- Asit üzerine su dökülmemeli, asit suyun içine damlatılmalıdır.
- Asitler ve bazlar alevden uzak tutulmalıdır.
- Asit ve baz şişeleri kapaklı ve etiketlenmiş olmalıdır.
- Asit ve baz çözeltileri kapalı yerlerde buharlaştırılmamalıdır.
- Metal kaplar içine asit ve baz konulmamalı, cam ya da plastik kaplar içinde saklanmalıdır.
- Asit yada baz çözeltisi vücudunuza sıçrarsa, o bölge bol su ile yıkanmalıdır.
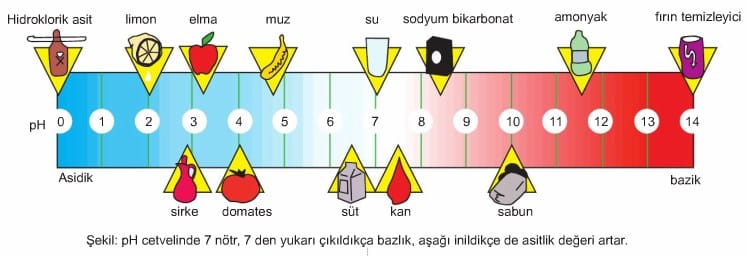
Asit ve Bazlarda pH Kavramı
Bir çözeltideki H+ iyonları sayısı, OH– iyonları sayısından fazla ise çözelti asidik, az ise çözelti bazik özelliktedir. Çözeltinin asidik ya da bazik özellikte olduğunu belirtmek İçin pH değerleri karşılaştırılır.
Asit Yağmurları
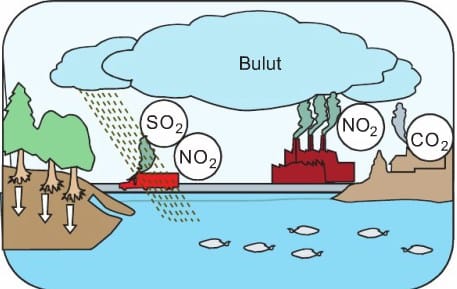
Günümüzün en önemli çevre sorunlarından biri asit yağmurlarıdır. Peki asit yağmuru nedir? Aşağıdaki resmi inceleyerek asit yağmurlarının nasıl oluştuğunu ve çevreye verdiği zararları tahmin edelim.
Ev ve iş yerlerinde fosil yakıtların kullanılması sonucunda çıkan baca gazları, motorlu taşıtlardan çıkan egzoz gazları hava kirliliğine sebep olur. Hava kirliliğine sebep olan başlıca gazlar:
karbon dioksit (CO2), kükürt dioksit (SO2) ve azot dioksiftir (NO2).
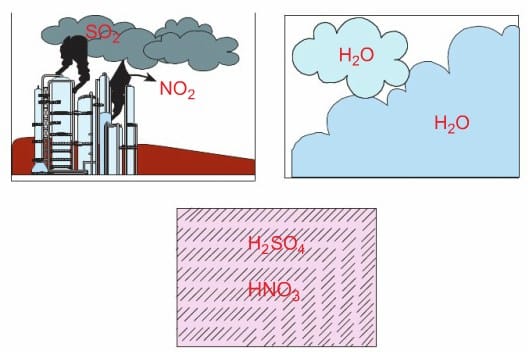
Bu gazlar atmosferde çeşitli değişmelere uğrayarak zaman zaman rüzgârın da etkisiyle çok uzaklara taşınabilmektedir. Buraya kadar meydana gelen olaylarda bize zarar verecek bir durum görmediniz değil mi? Asıl olay şimdi başlıyor. Bu gazlar hiç de o kadar masum değiller, uygun ortam bulduklarında bakın neler yapıyorlar. Bu gazlar bulutlardaki su buharı ve diğer maddelerle tepkimeye girerek sülfürik asit (H2SO4) ve nitrik asit (HNO3) gibi maddelerin oluşumuna yol açmaktadır.
Asidik özellik taşıyan bu gazlar, bulut oluşturduğunda yağan yağmur asit yağmuru olarak adlandırılır. Bu yağmurun pH derecesi ikiye kadar düşebilmektedir. Bu durum yalnız yağmurda değil, diğer bütün yağış biçimlerinde de görülebilmektedir. Asit yağmurları yağdıkları bölgeye çeşitli zararlar verir. Resimde, uzun süreli yağan asit yağmurlarının ormanlık bir bölgeye verdiği zarar görülmektedir. Bu durumda asit yağmurlarının orman yangınları kadar çevreye zararlı olduğunu söyleyebilir miyiz? Ülkemizde asit yağmurlarının olumsuz etkileri Samsun Gelemen ve Muğla, Yatağan gibi ormanlık bölgelerde görülmektedir.
ÇÖZÜMLÜ TEST SORULARI
Soru 1:
Aşağıdakilerden hangisi asitlerin özelliklerinden biri değildir?
A) Tatları ekşidir
B) Turnusol kağıdını kırmızıya çevirir
C) Sulu çözeltilerinde OH⁻ iyonu bulundurur
D) Metallere aşındırıcı etki yapar
Çözüm:
Asitler H⁺ iyonu, bazlar OH⁻ iyonu bulundurur.
Cevap: C
Soru 2:
pH değeri 2 olan bir çözelti için ne söylenebilir?
A) Kuvvetli bazdır
B) Kuvvetli asittir
C) Nötrdür
D) Zayıf bazdır
Çözüm:
pH 0-7 arası asidik, 7 nötr, 7-14 bazik özellik gösterir.
Cevap: B
Soru 3:
Aşağıdakilerden hangisi günlük hayatta kullandığımız bazlara örnektir?
A) Limon suyu
B) Sirke
C) Sabun
D) Portakal suyu
Çözüm:
Sabun bazik özellik gösterir.
Cevap: C
Soru 4:
Asit yağmurları en çok hangi yapılara zarar verir?
A) Ahşap evler
B) Mermer heykeller
C) Plastik oyuncaklar
D) Cam binalar
Çözüm:
Asitler karbonatlı yapıları (mermer) aşındırır.
Cevap: B
Soru 5:
Nötralleşme tepkimesi sonucu hangisi oluşur?
A) Tuz + Su
B) Asit + Baz
C) Metal + Su
D) Gaz + Isı
Çözüm:
Asit + Baz → Tuz + Su
Cevap: A