Periyodik Özelliklerin Değişimi 9.Sınıf kimya
Periyodik Özellikler
Periyodik sistemde elementler artan atom numarasına göre yerleştikten sonra bilim insanları elementlerin bu düzende başka özelliklerini incelemişlerdir. Periyodik sistemde elementlerin fiziksel ve kimyasal özellikleri aynı grupta ve periyotta oldukça düzenli bir değişim gösterir. Periyodik sistemde elementlerin düzenli değişen bu özellikleri aşağıda sıralanmıştır.
Atom Yarıçapı
Atom, elementlerin gözle görülmeyen en küçük yapı taşları olduğundan boyutlarının ölçülmesinin pek kolay olmayacağı düşünülmelidir. Elektronlar çekirdek etrafındaki yörüngelerde kesin sınırları olmadan hareket ederler. Bu nedenle atom yarıçapının doğrudan hesaplanması mümkün değildir. Dolaylı yoldan yapılan atom yarıçapı tanımına göre, “aynı elementin birbirine temas eden bağlı iki atomun çekirdekleri arasındaki mesafenin yarısı” şeklinde tanımlanabilir.
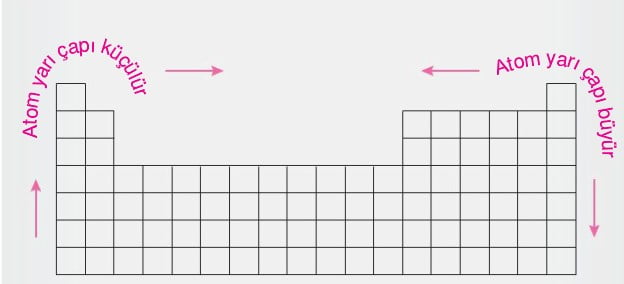
- Aynı periyotta, soldan sağa doğru gidildikçe; proton sayısı arttığından, çekirdeğin çekim kuvveti artar. Böylece en dış katmandaki elektronlara uygulanan etkin çekim kuvveti artacağından atom yarıçapı azalır.
- Aynı grupta, yukarıdan aşağı doğru gidildikçe; proton sayısı arttığından çekirdeğin çekim kuvveti artar. Böylece katman sayısındaki artışla birlikte elektronlara uygulanan etkin çekim kuvveti azalacağından atom yarıçapı artar.
İyonlaşma Enerjisi
Atomun yörüngesinde bulunan elektronlar çekirdekteki protonlar tarafından kuvvetlice çekilir. Bu elektronların koparılması için çekimden kurtaracak kadar enerji vermek gerekir. Verilmesi gereken enerji ne kadar yüksekse atomun kararlılığı da o kadar fazladır.
Katı ve sıvı fazda atomlar birbirine yakın olduğundan etkileşimler fazladır. Bu nedenle bir elektronun atomdan koparılması için gereken enerji hesaplanacaksa etkileşimleri minimuma indirmek için atomları gaz fazına getirmek gerekir. İyonlaşma enerjisi, gaz fazında bulunan kararlı bir atomdan elektronları birer birer koparmak için gereken minimum enerjidir.
Nötr bir atomdan bir elektron koparmak için gereken enerjiye, birinci iyonlaşma enerjisi denir. (İE1)
![]()
1+ yüklü iyondan, bir elektron koparmak için gereken enerjiye, ikinci iyonlaşma enerjisi denir. (İE2)
![]()
NOT
- Benzer şekilde bir atomun kaç tane elektronu varsa o sayı kadar İyonlaşma enerji değeri yazılabilir.
- Aynı periyotta, soldan sağa doğru gidildikçe en dış katmandaki elektronlara çekirdek tarafından uygulanan etkin çekim kuvveti artacağından elektronu koparmak güçleşir ve verilmesi gereken enerji artar.
- Periyodik sistemin aynı periyodunda soldan sağa doğru gidildikçe A gruplarının İyonlaşma enerjilerinde 1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A sıralaması vardır.
- Aynı grupta, yukarıdan aşağıya doğru elektronun çekirdekten uzaklaşma etkisi proton artışından daha baskın kaldığı için elektrona uygulanan çekim kuvveti ve koparılması için gereken enerji azalır.
- Bir atoma ait bir sonraki iyonlaşma enerjisi her zaman büyük olur. Çünkü atomdan bir elektron koparıldığında kalan elektron başına düşen çekim kuvveti proton sayısı sabit kaldığı için artar. Bu da diğer elektronların kopması için gereken enerjiyi arttırır.
İE1 < İE2 < İE3 < … - Hiçbir zaman atomların herhangi bir İyonlaşma enerji değeri negatif olamaz.
NOT
Elektron İlgisi (Eİ)
Gaz halindeki bir atomun bir elektron alması sırasındaki enerji değişimini gösteren sayısal ifadedir.
Bir atoma doğru yaklaşan bir elektron atom çekirdeği tarafından çekildiğinde, elektronun yüksek enerjiden düşük enerjiye düşmesiyle birlikte enerji açığa çıkar. Açığa çıkan enerji ne kadar yüksek ise atomun elektron ilgisinin o kadar fazla olduğu anlaşılmalıdır.
NOT
Elektron ilgileri genellikle ekzotermiktir. Ancak 2A grubu, 7N ve soygazların elektron ilgileri pozitiftir. (Endotermiktir)

Periyodik cetvelde aynı grupta yukarıdan aşağıya inildikçe elektron ilgisi azalır, soldan sağa doğru artar.
NOT
- Soygaz atomlarının yüksek kararlılıkta olmasından dolayı elektron ilgileri yoktur.
- Periyodik cetvelde elektron ilgisi en yüksek olan element Klor (Cl) dur.
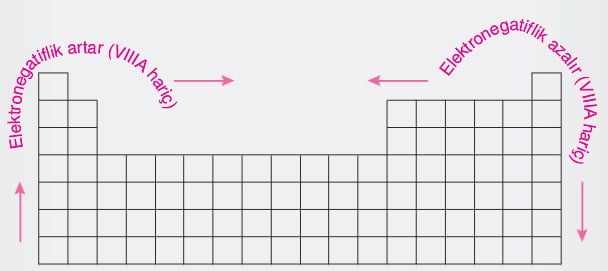
Elektronegatiflik
Bağ elektronlarını kendine doğru çekme isteğinin bir ölçüsüdür. Ametal atomlarının elektron alma eğilimleri yüksek olduğundan bağ elektronlarını çekme güçleri yüksektir.
H ve Cl atomlarına ait elektronların ortaklaşa kullanılması sonucu oluşan elektron bulutu klor atomuna daha fazla yaklaşır. Genel olarak elektronegatiflik değeri ne kadar küçükse element o kadar metal, ne kadar büyükse 0 kadar ametal karakterlidir.
- Periyodik cetvelde soldan sağa doğru gidildikçe atom yarıçapı azaldığından İyonlaşma enerjisi ve elektronegatiflik artar.
- Aynı grupta yukarıdan aşağıya doğru inildikçe atom yarıçapı artacağından İyonlaşma enerjisi ve elektronegatiflik azalır.
NOT
- Elektronegatiflik ve elektron ilgisi kavram olarak birbiriyle karıştırılmaktadır. Elektron ilgisi elektron alma isteği, elektronegatiflik ise bağ elektronlarını çekme isteğidir.
- Periyodik cetvelde elektronegatiflik değeri en yüksek olan element flor (F) dur.
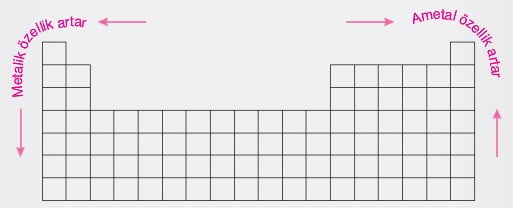
Elementlerin Metalik ve Ametalik Özelliklerinin Değişimi:
Elementlerin kimyasal tepkimeye girme isteklerine aktiflik denir. Aktiflik metalik ve ametalik aktiflik olmak üzere ikiye ayrılır.
- Metalik aktiflik, bir atomun elektron verme isteğinin bir ölçüsüdür. Bir elementin İyonlaşma enerjisi azaldıkça, elektron verme eğilimi, metalik özelliği ve buna bağlı olarak da metalik aktifliği artar.
- Ametalik aktiflik ise bir atomun elektron alma eğiliminin bir ölçüsüdür. Bir elementin elektron ilgisi arttıkça, elektron alma eğilimi, ametalik özelliği ve buna bağlı olarak da ametal aktifliği artar.
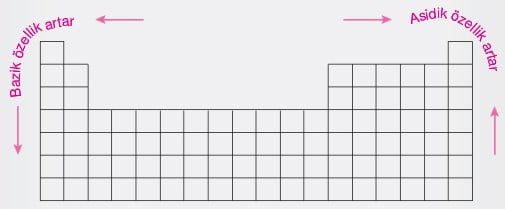
Elementlerin Asitlik ve Bazlık Özelliklerinin Değişimi
Sulu çözeltilerine H+ iyonu vererek çözünen maddelere asit, OH– iyonu vererek çözünen maddelere baz denir.
- Periyodik cetvelde metalik özellik gösteren elementlerin oksitlerinin sulu çözeltileri bazik karakterlidir.
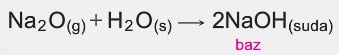
- Periyodik cetvelde ametalik özellik gösteren elementlerin oksitlerinin sulu çözeltileri asidik karakterlidir.
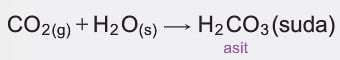
Çözümlü Örnek Test Soruları: Periyodik Özelliklerin Değişimi
Soru 1
Bir periyotta soldan sağa doğru gidildikçe atom çapı nasıl değişir?
A) Artar
B) Azalır
C) Sabit kalır
D) Önce artar, sonra azalır
Çözüm:
Bir periyotta soldan sağa doğru gidildikçe atom numarası artar. Bu durumda çekirdek yükü artar ve çekirdek elektronları daha güçlü çeker. Bu nedenle atom çapı azalır.
Cevap: B) Azalır
Soru 2
Aşağıdaki özelliklerden hangisi bir grupta yukarıdan aşağıya doğru gidildikçe artar?
A) İyonlaşma enerjisi
B) Elektronegatiflik
C) Atom çapı
D) Elektron ilgisi
Çözüm:
Bir grupta yukarıdan aşağıya doğru gidildikçe atom çapı artar, çünkü her bir alt sırada yeni bir enerji seviyesi eklenir. Bu durum atom çapının artmasına neden olur.
Cevap: C) Atom çapı
Soru 3
Aynı periyotta bulunan elementler için aşağıdaki özelliklerden hangisi genellikle artar?
A) Atom yarıçapı
B) Metalik özellik
C) İyonlaşma enerjisi
D) Elektron ilgisi azalır
Çözüm:
Aynı periyotta soldan sağa gidildikçe iyonlaşma enerjisi genellikle artar. Çünkü atom numarası arttıkça çekirdek yükü artar ve elektronları çekme gücü de artar.
Cevap: C) İyonlaşma enerjisi
Soru 4
Aşağıdaki elementlerden hangisinin elektron ilgisi en yüksektir?
A) Oksijen
B) Flor
C) Klor
D) Karbon
Çözüm:
Flor, periyodik tabloda elektronegatifliği ve elektron ilgisi en yüksek elementtir. Elektron ilgisi, atomun bir elektronu kendine çekme isteğiyle ilgilidir.
Cevap: B) Flor
Soru 5
Aşağıdaki ifadelerden hangisi periyodik özelliklerin değişimi ile ilgili doğru değildir?
A) Bir grupta yukarıdan aşağıya doğru gidildikçe metalik özellik artar.
B) Bir periyotta soldan sağa doğru gidildikçe ametalik özellik artar.
C) Bir periyotta soldan sağa doğru gidildikçe atom çapı artar.
D) Bir grupta yukarıdan aşağıya doğru gidildikçe iyonlaşma enerjisi azalır.
Çözüm:
Bir periyotta soldan sağa doğru gidildikçe atom çapı azalır, çünkü çekirdek yükü artar ve atom elektronları çekirdeğe daha yakın olur. Bu nedenle C ifadesi yanlıştır.
Cevap: C) Bir periyotta soldan sağa doğru gidildikçe atom çapı artar.
Soru 6
Bir periyotta soldan sağa doğru gidildikçe aşağıdaki özelliklerden hangisi azalır?
A) Atom çapı
B) Elektron ilgisi
C) İyonlaşma enerjisi
D) Ametal özellik
Çözüm:
Bir periyotta soldan sağa gidildikçe atom çapı azalır. Çekirdek yükü arttığı için çekim gücü de artar ve elektronlar çekirdeğe daha yakın olur.
Cevap: A) Atom çapı
Soru 7
Bir grupta yukarıdan aşağıya gidildikçe aşağıdaki özelliklerden hangisi azalır?
A) Metalik özellik
B) Atom yarıçapı
C) Elektronegatiflik
D) Proton sayısı
Çözüm:
Bir grupta yukarıdan aşağıya doğru gidildikçe elektronegatiflik azalır, çünkü atom çapı büyür ve çekirdekten uzak olan elektronları çekme gücü azalır.
Cevap: C) Elektronegatiflik



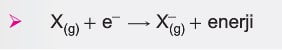


çok güzel işime çok yaradı
çok güzel performans ödevim için çok yaradı
İsmim gibi çok güzel olmuş inş hoca kabul eder
çok teşekkürler performans ödevim çok güzel oldu
bizimde adımız çıksın abb