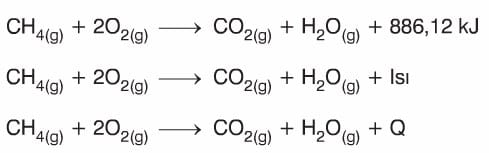Kimyasal Tepkimelerde Enerji 10. Sınıf
Kimyasal olaylar gerçekleşirken tepkimeye giren maddelerdeki atomlar arası bağların yeniden düzenlenmesi sırasında enerji alınır veya verilir. Bu nedenle kimyasal tepkimelerde her zaman enerji alışverişi meydana gelir. Bazı kimyasal tepkimeler gerçekleştiğinde dışarı enerji verir. Bu enerji ısı, ışık veya elektrik enerjisi türünden olabilir. Örneğin, mum, odun ve doğal gaz gibi yanıcı maddeler yakıldığında dışarı hem ısı hem de ışık enerjisi verir.
Ekzotermik Tepkimeler
Bir tepkime sonucu enerji açığa çıkıyorsa tepkime ekzotermik tir. Enerji tepkime denkleminde ürünler tarafında gösterilir. Enerji tepkime denklemine yazılırken enerji türlerini belirten semboller de kullanılabilir. Örneğin ısı için Q sembolü kullanılabilir.
Endotermik Tepkimeler
Bir tepkime dışarıdan enerji alarak gerçekleşiyorsa tepkime endotermik tir. Enerji tepkime denkleminde girenler tarafında gösterilir. Örneğin, N2 gazını O2 ile yakmak için dışarıdan ısı enerjisi verilmelidir.
Isı + N2(g) + 2O2(g) → 2NO2(g)
Elektroliz adı verilen bir işlemle su kendini oluşturan hidrojen ve oksijen elementlerine ayrılırken elektrik enerjisi kullanılır.
2H2O(s) + Elektrik enerjisi → 2H2(g) + O2(g)
Bilgi: Kimyasal tepkimeler enerji değişimlerine göre endotermik ve ekzotermik olarak ikiye ayrılırlar.