Kimyasal Tepkimeler ve Denklemler Soruları ve Çözümleri 10. Sınıf
Çözümlü Örnek Test Soruları
Soru 1
Aşağıdaki kimyasal tepkime denklemini denkleştiriniz:
Al + O₂ → Al₂O₃
A) 2Al + 3O₂ → Al₂O₃
B) 4Al + 3O₂ → 2Al₂O₃
C) 2Al + O₂ → Al₂O₃
D) Al + O₂ → Al₂O₃
E) 4Al + O₂ → 2Al₂O₃
Çözüm
Bu tepkimeyi denkleştirmek için her iki tarafta da aynı sayıda atom olmalıdır. Sağ tarafta 2 Al ve 3 O atomu olduğundan denkleştirme 4Al + 3O₂ → 2Al₂O₃ olur.
Cevap: B
Soru 2
Aşağıdaki kimyasal denklemlerden hangisi yanma tepkimesidir?
A) C + O₂ → CO₂
B) CaCO₃ → CaO + CO₂
C) NaOH + HCl → NaCl + H₂O
D) KClO₃ → KCl + O₂
E) NH₃ + HCl → NH₄Cl
Çözüm
Yanma tepkimeleri oksijen gazı (O₂) ile gerçekleşir ve genellikle karbondioksit ve su açığa çıkar. Bu tanıma uyan tepkime C + O₂ → CO₂’dir.
Cevap: A
Soru 3
Aşağıdaki tepkimeyi denkleştiriniz:
H₂ + O₂ → H₂O
A) H₂ + O₂ → 2H₂O
B) 2H₂ + O₂ → 2H₂O
C) 2H₂ + 2O₂ → 2H₂O
D) H₂ + 2O₂ → H₂O
E) 2H₂ + O₂ → H₂O
Çözüm
Denkleştirme işlemi, her iki tarafta aynı sayıda H ve O atomları olacak şekilde yapılır. Bu, 2H₂ + O₂ → 2H₂O şeklinde denkleştirilir.
Cevap: B
Soru 4
Aşağıdaki bileşiklerden hangisinin çözünmesi sonucunda çözelti asidik olur?
A) NaCl
B) KOH
C) HCl
D) Na₂CO₃
E) CaO
Çözüm
Asidik özellik gösteren bileşik hidrojen iyonu (H⁺) içerir. Hidrojen klorür (HCl) çözündüğünde H⁺ iyonları açığa çıkar ve çözeltinin asidik olmasına neden olur.
Cevap: C
Soru 5
Aşağıdaki tepkime denklemi için eksik katsayıları bulunuz:
Fe + H₂O → Fe₃O₄ + H₂
A) 3, 4, 1, 2
B) 3, 4, 1, 4
C) 3, 4, 1, 3
D) 3, 4, 1, 6
E) 3, 4, 2, 4
Çözüm
Denkleştirme işlemi sonucunda katsayılar 3Fe + 4H₂O → Fe₃O₄ + 4H₂ şeklinde bulunur.
Cevap: B
Soru 6
Bir tepkimede ürünlerin kütlesi tepkimeye giren maddelerin toplam kütlesine eşittir. Bu hangi kanunu ifade eder?
A) Sabit Oranlar Kanunu
B) Kütlenin Korunumu Kanunu
C) Enerjinin Korunumu Kanunu
D) Dalton Atom Teorisi
E) Avogadro Kanunu
Çözüm
Kütlenin Korunumu Kanunu, tepkimeye giren maddelerin toplam kütlesinin ürünlerin toplam kütlesine eşit olduğunu belirtir.
Cevap: B
Soru 7
Aşağıdaki tepkime türlerinden hangisi indirgenme tepkimesidir?
A) Yanma
B) Sentez
C) Çözünme
D) Redüksiyon
E) Asit-Baz
Çözüm
İndirgenme, bir elementin elektron kazanması anlamına gelir. Bu tepkime türüne redüksiyon denir.
Cevap: D
Soru 8
Bir kimyasal tepkimenin hızını artırmak için aşağıdaki yöntemlerden hangisi uygulanmaz?
A) Sıcaklığı artırmak
B) Derişimi artırmak
C) Katalizör eklemek
D) Basıncı azaltmak
E) Temas yüzeyini artırmak
Çözüm
Tepkime hızını artırmak için sıcaklık, derişim ve temas yüzeyi artırılır, katalizör eklenir. Ancak basıncı azaltmak tepkime hızını artırmaz, hatta bazı durumlarda yavaşlatır.
Cevap: D
Mol – Hacim İlişkisi: Normal şartlar altında (NŞA) veya normal koşullarda (NK) yani 0° C ve 1 atm basınç altında 1 mol gaz 22,4 L hacim kaplar. Oda koşullarında veya standart koşullarda yani 25° C ve 1 atm basınç altında 1 mol gaz 24,5 L hacim kaplar.
Mol Karışımları: Farklı maddelerden oluşan karışımlarda maddelerin mol sayılarını bulabilmek için karışımla ilgili verilen bilgilerden yararlanılarak denklem kurulur ve karışımı oluşturan maddelerin miktarları hesaplanır.
Kimyasal Tepkime: Maddelerin iç yapısında (elektron düzeninde) meydana gelen ve maddelerin türünü değiştiren olaylara kimyasal tepkime denir. Bir kimyasal tepkimenin varlığı ısı alışverişi, gaz çıkışı, renk değişimi ve çökelek oluşumu gibi değişimlerden anlaşılabilir. Kimyasal tepkimeler denklemlerle gösterilir. Denklemin sol tarafında girenler (reaktifler), sağ tarafında çıkanlar (ürünler) yer alır.
Kimyasal Tepkimelerde;
1. Atom sayısı ve türü, toplam kütle, toplam elektron sayısı, toplam yük, çekirdek yapısı (proton ve nötron sayısı), toplam enerji gibi özellikler korunur, yani değişmez.
2. Maddenin cinsi, bağ yapısı, elektron düzeni, kimlik özellikleri, tanecik yapısı, element olarak tepkimeye giren maddenin değerliği değişir.
3. Mol sayısı, madde sayısı, basınç, hacim, sıcaklık ve molekül sayısı gibi özellikler değişebilir.
Bazı tepkimelerde, tepkimenin gerçekleştiği koşullar ve bazı maddeler (sıcaklık, basınç ve (katalizör) okun altına veya üstüne yazılabilir.
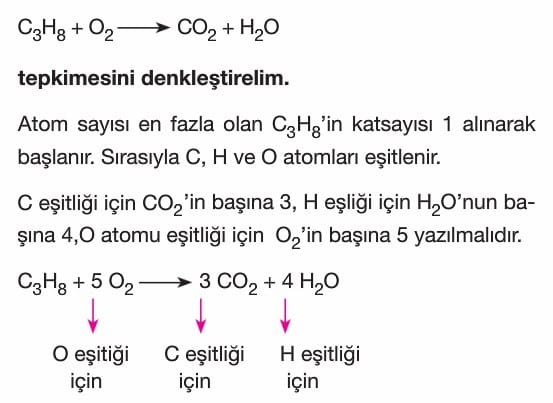
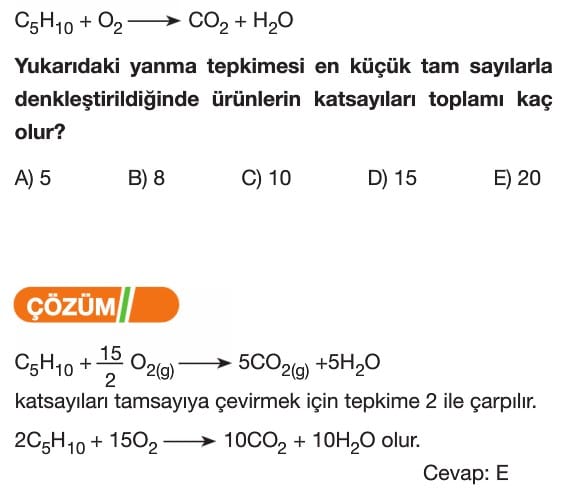
Denklem Denkleştirme:
1. Atom sayısı fazla olan maddenin katsayısı 1 alınarak başlanır.
2. Tepkimede önce metaller, sonra ametaller eşitlenir.
3. En son H ve O atomları eşitlenir.
4. Bileşiklerin başına rasyonel sayı gelmemesine dikkat edilir.