Kimyanın Temel Kanunları 10.Sınıf Kimya
Kütlenin Korunumu Kanunu
“Kütlenin Korunumu Kanunu,” maddenin yoktan var edilemeyeceğini ve yok edilemeyeceğini ifade eder. Bu temel ilke, 1789 yılında Antoine Lavoisier tarafından bilimsel bir temele oturtulmuştur. Lavoisier, yaptığı ünlü deneylerden birinde, bir miktar kalay örneğini içinde hava bulunan bir cam balona koyarak balonun ağzını sıkıca kapattı ve sistemin kütlesini tarttı. Daha sonra cam balonu ısıtarak kalayın oksitlenmesini sağladı. Reaksiyon sonrası, cam balonun içindeki madde şekil değiştirse de toplam kütlenin değişmediğini gözlemledi. Bu deney, kimyasal reaksiyonlarda madde miktarının korunacağını kanıtladı ve modern kimyanın temellerinden biri haline geldi.
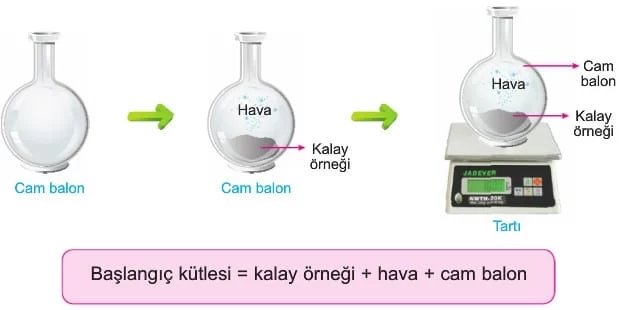
Lavoisier, deneyinde kalay örneğini içinde hava bulunan kapalı bir cam balona yerleştirdi ve balonun ağız kısmını sıkıca kapattıktan sonra tarttı. Ardından cam balonu ısıttı ve kalayın, reaksiyon sonucu tebeşir tozuna benzer bir katıya dönüştüğünü gözlemledi. Bu süreçte balonun içindeki toplam kütlenin değişmediğini fark etti. Bu buluş, maddenin ne yoktan var olabileceğini ne de tamamen yok edilebileceğini bilimsel olarak kanıtladı ve kimya bilimine “Kütlenin Korunumu Kanunu”nu kazandırdı.
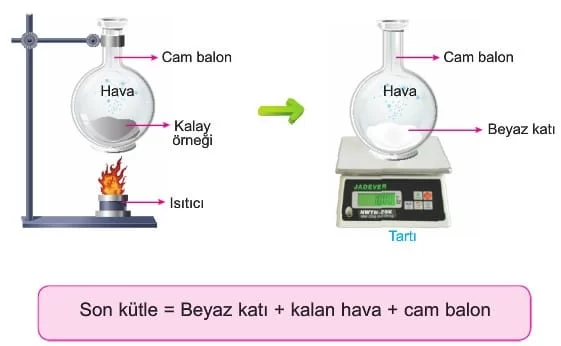
Başlangıç Kütlesi = Son Kütle
Lavoisier, yapmış olduğu bu deneylerin sonuçlarını; “Doğanın tüm işleyişlerinde hiçbir şey yoktan var olmaz. Tüm dönüşümlerde maddenin miktarı aynı kalır.” şeklinde ifade etmiştir.
Dalton Atom Teorisi’ndeki; “kimyasal olaylarla atomların sayıları ve türleri değişmez, ancak atomlar yeniden düzenlenerek farklı maddeleri oluşturur.” ifadesi kütlenin nasıl korunduğunu açıklar. Çünkü atomların sayısı ve türleri değişmiyorsa kütlenin de değişmemesi gerekir.
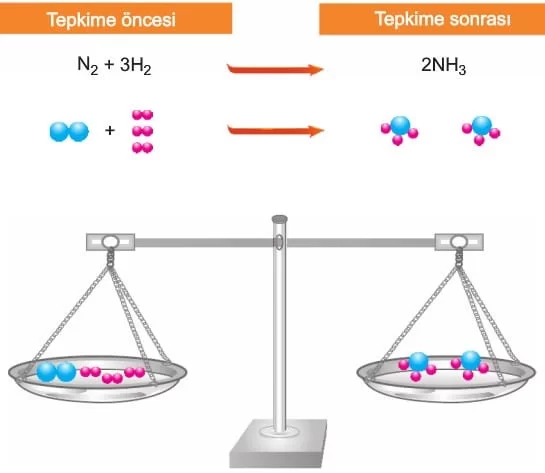
Azot (N2) ve hidrojen (H2)’den amonyak (NH3) oluştururken atom sayıları ve kütle korunur.
Kütlenin Korunumu Kanunu Soru Çözümleri
Sabit Oranlar Kanunu
Dalton Atom Teorisi’ne göre, bir bileşiği oluşturmak için belirli elementlerin belirli sayıdaki atomlarının bir araya gelmesi gerekir. Bu fikir, 1799 yılında Fransız kimyacı Joseph Proust tarafından ortaya konulan ve bugün “Sabit Oranlar Kanunu” olarak bilinen yasanın bir devamıdır. Proust, elementlerin bir bileşik oluştururken her zaman belirli kütle oranlarında birleştiğini deneylerle göstermiştir.
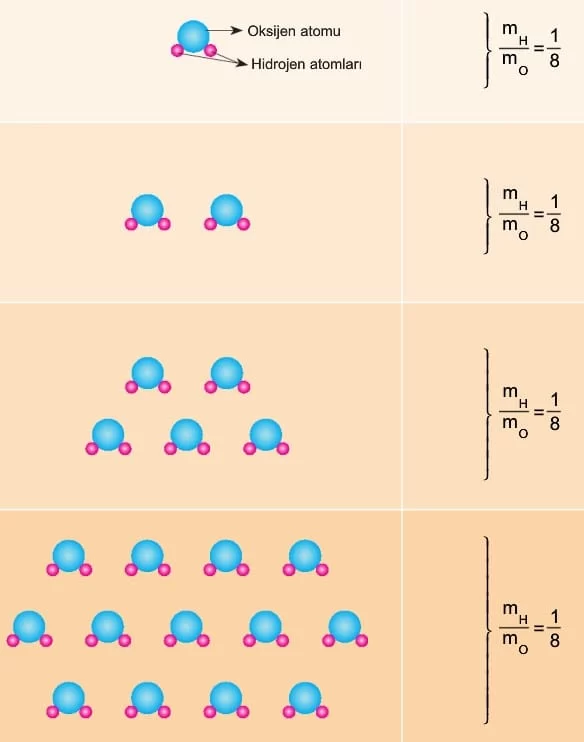
Bu kanunu daha iyi anlamak için suyu oluşturan elementlerin kütle oranlarına bakabiliriz. Örneğin, 18 gram suyun 16 gramı oksijen, 2 gramı ise hidrojenden oluşur. Eğer 9 gram su incelenirse bunun 8 gramı oksijen, 1 gramı hidrojendir. Burada hidrojenin kütlesinin oksijene oranı daima 1/8’dir. Bu oran, suyun miktarı veya bulunduğu çevre ne olursa olsun hiçbir şekilde değişmez. Bu durum, bir bileşiği oluşturan elementlerin kütlece sabit oranlarda birleştiğini kanıtlar.
Sabit oranlar, molekül sayısına bağlı olarak değişmez ve her zaman sabit kalır. Örneğin, kalsiyum oksit (CaO) bileşiğinde, kalsiyumun (Ca) oksijene (O) kütle oranı daima 5/2’dir. Kalsiyum ve oksijenin miktarlarına göre oluşan kalsiyum oksit bileşiğinin toplam kütlesi değişebilir, ancak kütleler arasındaki bu oran her koşulda sabit kalır.
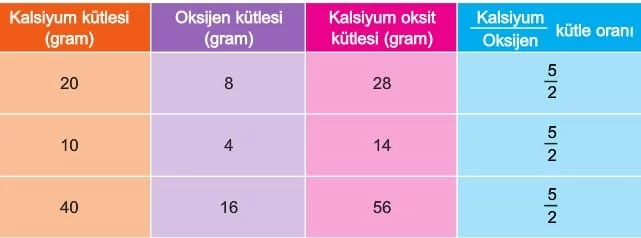
Dalton Atom Teorisine göre, bir elementin bütün atomları kütlece aynıdır. O hâlde, bir bileşiğin yüzde bileşimi yani onu oluşturan elementlerin bileşikteki kütle oranı tek bir değer olmalıdır. Demek ki Dalton Atom Teorisi, sabit oranın nasıl oluştuğunu açıklar.

Sabit Oranlar Kanunu Soru Çözümleri
Katlı Oranlar Kanunu
Bileşiklerde elementler arasındaki kütle oranı her zaman sabit olmasına rağmen, aynı elementlerin farklı oranlarda birleşerek farklı özellikler gösteren bileşikler oluşturduğu durumlar da gözlemlenmiştir. Örneğin, karbon ve oksijen birleştiğinde tamamen farklı özelliklere sahip iki bileşik oluşur. Karbonmonoksit son derece zehirli bir gazdır, oysa karbondioksit, solunum yoluyla dışarı attığımız zehirli olmayan bir gazdır ve yeşil bitkilerin fotosentez yaparak yaşamlarını sürdürmeleri için hayati öneme sahiptir.
Dalton, element çiftlerinin oluşturduğu farklı bileşikleri inceleyerek şu sonuca ulaşmıştır: “Eğer bir element başka bir elementle birden fazla bileşik oluşturuyorsa, elementlerden birinin sabit miktarı ile diğerinin değişen miktarları arasında tam ve basit sayılarla ifade edilen bir oran bulunur.” Bu prensibi Katlı Oranlar Kanunu olarak adlandırmıştır.
Örneğin, karbondioksit molekülünde 12 gram karbon 32 gram oksijenle birleşirken, karbonmonoksitin 28 gramında 12 gram karbon 16 gram oksijenle birleşir. Her iki bileşikte de 12’şer gram karbon bulunmasına rağmen, birinde oksijen miktarı 32 gram, diğerinde 16 gramdır. Bu iki bileşiği karşılaştırdığımızda oksijen kütleleri arasındaki oran 32/16 = 2’dir. Bu, karbon atomu başına oksijen atomu sayısının sırasıyla “2” ve “1” olmasından kaynaklanır ve Dalton Atom Teorisi’nin Katlı Oranlar Kanununu doğrular.
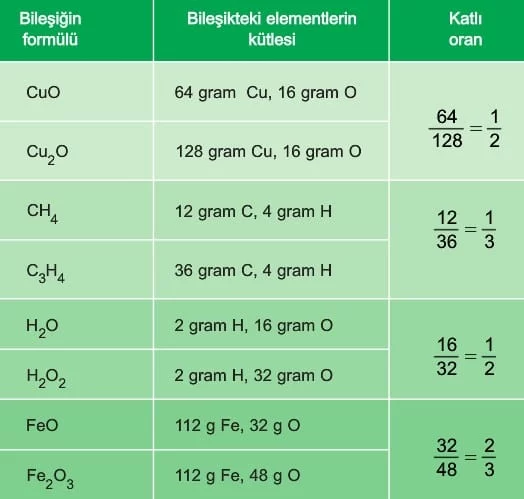
Katlı Oranlar Kanunu’nun uygulanabilmesi için:
- Bileşiklerin aynı iki elementten oluşması gerekir. Katlı oranlar kanunu sadece aynı iki elementin oluşturduğu bileşiklerde geçerlidir. Örneğin, N₂O ve CO₂ arasında katlı oran belirlenemez, çünkü elementleri farklıdır. Aynı şekilde, HClO₃ ve HClO₄ arasında da katlı oran belirlenemez, çünkü üç farklı element içerirler.
- Bileşiklerin içerdiği element atomlarının sayıca oranı aynı olmamalıdır. Eğer bileşiklerdeki elementlerin oranı aynıysa katlı oran belirlenemez. Örneğin, C₂H₄ ve C₃H₆ bileşikleri arasında katlı oran yoktur, çünkü her ikisinde de C ve H atomlarının oranı 2/4 = 3/6 = 1/2’dir, yani aynıdır.
Katlı Oranlar Kanunu Soru Çözümleri
Kimyanın Temel Kanunları Video
Çözümlü Örnek Test Soruları
Kütlenin Korunumu Kanunu
- Bir kimyasal tepkimede giren maddelerin toplam kütlesi 80 gramdır. Bu tepkimede oluşan ürünlerin toplam kütlesi ne kadar olacaktır?
A) 70 g
B) 80 g
C) 90 g
D) 100 g
Çözüm: Kütlenin korunumu kanununa göre kimyasal bir tepkimede giren maddelerin toplam kütlesi, ürünlerin toplam kütlesine eşit olmalıdır. Dolayısıyla cevap B‘dir. - 2 gram hidrojen ve 16 gram oksijen, su oluşturmak üzere tepkimeye giriyor. Bu tepkimede kaç gram su oluşur?
A) 14 g
B) 16 g
C) 18 g
D) 20 g
Çözüm: Kütlenin korunumu kanununa göre giren maddelerin toplam kütlesi ürünlerin toplam kütlesine eşit olacaktır. Hidrojen ve oksijenin toplam kütlesi 2 + 16 = 18 gramdır. Bu nedenle 18 gram su oluşacaktır. Doğru cevap C‘dir.
Sabit Oranlar Kanunu
- Bir bileşiğin formülü sabit olduğunda bileşenlerinin kütle oranı nasıl olur?
A) Değişken
B) Sabit
C) Rastgele
D) Tepkimeye bağlı
Çözüm: Sabit oranlar kanununa göre, bir bileşiği oluşturan elementler her zaman sabit bir kütle oranında birleşirler. Doğru cevap B‘dir. - Bir bileşikteki karbon ve oksijen atomlarının kütlece birleşme oranı 3:8’dir. 9 gram karbon, yeterli miktarda oksijenle birleşirse kaç gram karbondioksit oluşur?
A) 24 g
B) 30 g
C) 32 g
D) 36 g
Çözüm: 3 gram karbon 8 gram oksijenle birleştiğine göre, 9 gram karbon 3 katı olan 24 gram oksijenle birleşir. Toplamda 9 + 24 = 33 gram karbondioksit oluşur. Doğru cevap D‘dir.
Katlı Oranlar Kanunu
- Katlı oranlar kanunu hangi durumda geçerlidir?
A) Farklı elementler farklı oranlarda birleştiğinde
B) Aynı elementler farklı oranlarda birleştiğinde
C) Elementler aynı oranda birleştiğinde
D) Farklı tepkimelerde farklı maddeler oluştuğunda
Çözüm: Katlı oranlar kanununa göre, aynı elementlerin birden fazla bileşik oluşturduğu durumlarda bu bileşiklerdeki elementlerin kütleleri arasındaki oranlar basit tam sayılarla ifade edilir. Doğru cevap B‘dir. - Katlı oranlar kanununa göre, aynı elementlerin farklı bileşiklerinde kütle oranı nasıl değişir?
A) Sabit kalır
B) Basit tam sayılarla ifade edilir
C) Rastgele değişir
D) Atom sayısına göre değişir
Çözüm: Katlı oranlar kanununa göre, elementlerin farklı bileşiklerdeki kütle oranları basit tam sayılarla ifade edilir. Doğru cevap B‘dir.
Çözümlü Örnek Test Soruları 2
Kimyanın Temel Kanunları
Soru 1: Sabit oranlar kanununa göre, bileşiklerin yapısındaki elementlerin kütle oranları nasıl olur?
A) Değişken
B) Sabit
C) Rastgele
D) Aynı elementte farklı
Cevap: B
Çözüm: Sabit oranlar kanununa göre, bir bileşikteki elementlerin kütle oranları her zaman sabittir.
Soru 2: 32 g oksijen ile 4 g hidrojen birleşerek suyu oluşturduğunda, hangi kanun geçerlidir?
A) Kütlenin Korunumu Kanunu
B) Sabit Oranlar Kanunu
C) Katlı Oranlar Kanunu
D) Kısmi Basınçlar Kanunu
Cevap: B
Çözüm: Sabit oranlar kanununa göre, suyu oluşturan hidrojen ve oksijen elementlerinin birleşme oranı sabittir.
Soru 3: Kimyanın temel kanunlarından hangisi “kütle korunur, yoktan var olmaz ve var olan kütle yok edilemez” ifadesini içerir?
A) Sabit Oranlar Kanunu
B) Kütlenin Korunumu Kanunu
C) Dalton Kanunu
D) Katlı Oranlar Kanunu
Cevap: B
Çözüm: Kütlenin korunumu kanunu, kimyasal reaksiyonlarda toplam kütlenin korunacağını belirtir.
Soru 4: 12 g karbon ile 32 g oksijenin birleşerek 44 g karbon dioksit oluşturması hangi kanunla açıklanır?
A) Dalton Kanunu
B) Sabit Oranlar Kanunu
C) Kütlenin Korunumu Kanunu
D) Avogadro Kanunu
Cevap: C
Çözüm: Kimyasal reaksiyonlarda toplam kütle korunur; bu olay kütlenin korunumu kanununa örnektir.
Soru 5: Sabit oranlar kanununa göre su molekülündeki hidrojen ve oksijenin kütle oranı nedir?
A) 1:8
B) 2:16
C) 2:1
D) 8:1
Cevap: A
Çözüm: Su molekülünde hidrojenin oksijene oranı sabit olup yaklaşık olarak 1:8’dir.
Soru 6: Aynı iki element birden fazla bileşik oluşturduğunda, elementlerin kütleleri arasında basit bir oran varsa hangi kanun geçerlidir?
A) Kütlenin Korunumu Kanunu
B) Sabit Oranlar Kanunu
C) Katlı Oranlar Kanunu
D) Gazların Kinetik Teorisi
Cevap: C
Çözüm: Katlı oranlar kanunu, aynı iki elementin farklı bileşiklerdeki kütle oranları arasında basit bir oran olduğunu belirtir.
Soru 7: 10 g element A ile 20 g element B’nin birleşerek 25 g bileşik oluşturması durumunda hangi kanun ihlal edilmiştir?
A) Sabit Oranlar Kanunu
B) Dalton Kanunu
C) Katlı Oranlar Kanunu
D) Kütlenin Korunumu Kanunu
Cevap: D
Çözüm: Kütlenin korunumu kanununa göre reaksiyonda toplam kütle korunmalıdır; burada 30 g yerine 25 g olduğu için kanun ihlal edilmiştir.
Soru 8: Hangi kanun, belirli sıcaklık ve basınç koşullarında gazların hacminin mol sayısıyla doğru orantılı olduğunu belirtir?
A) Kütlenin Korunumu Kanunu
B) Avogadro Kanunu
C) Sabit Oranlar Kanunu
D) Katlı Oranlar Kanunu
Cevap: B
Çözüm: Avogadro Kanunu, gazların hacminin mol sayısıyla doğru orantılı olduğunu ifade eder.


















