Atomun Tarihsel Gelişimi Kimya Ayt
ATOMUN TARİHSEL GELİŞİMİ
Dalton Atom Modeli
- Maddenin en küçük yapıtaşı atomdur ve atomlar parçalanamaz.
- Atomlar içi dolu kürelerdir.
- Bir elementin bütün atomları aynı özellikleri taşır ve diğer elementlerin özelliklerinden farklıdır.
- Atomlar belirli sayılarda birleşerek molekülleri oluştururlar.
- Katlı oranlar yasasını ortaya atmıştır.
Atom Altı Tanecikler
Bütün maddeler yüklü taneciklerden oluşur. Yüksüz denilen bir tanecik aslında eşit sayıda pozitif ve negatif yük içerir. Pozitif yüklü maddelerde pozitif yük sayısı negatif yük, negatif yüklü maddelerde ise negatif yük sayısı pozitif yük sayısından fazladır.
Nötr bir cisme negatif yüklü bir cisim yaklaştırılırsa negatif yükler uzaklaşır. Pozitif bir cisim yaklaştırılırsa negatif yükler yaklaşır. Bu olay etki ile elektriklenmedir. Ebonit çubuk eksi ile cam çubuk ise artı ile yüklenir.
Michael Faraday: Elektroliz deneyini ilk yapan kişidir. Yaptığı çalışmalarda elektrik yükünün tanecikli yapıya sahip olduğunu belirtmiştir. Bir atom belli miktar veya bu miktarın katları şeklinde elektrik yükü taşıyabilir. Bütün atomlarda taşınan bu elektrik yükü aynıdır.
1,118 mg Ag çıkaran elektrik yüküne 1C (coulomb) denir.
Humphry DAVY: Bileşikleri ayrıştırmak için elektrik akımını kullanmıştır. Elementlerin elektriksel nitelikli çekim kuvveti ile bir arada tutulduğunu ifade etmiştir. K, Na, Ca, Sr ve Ba elementlerini saf olarak elde etmiştir.
G.J. STONEY: Atomlarda elektrik yüklü birimler bulunduğunu belirtmiş ve bunlara elektron adını vermiştir. Her maddede bu elektrik yüklerinin farklı olduğunu ve bunlarla eşit miktarda pozitif yük olduğunu belirtmiştir.
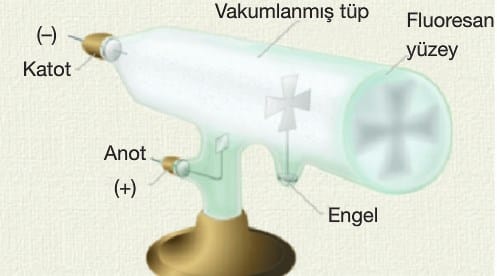
William CROOKES: Elektronun varlığını dair ilk kanıtları bulmuştur. Crookes tüpünde elektrotlar arasında yüksek bir gerilim uygulanırsa bir elektrik akımı gözlenir ve tüpteki hava renkli bir ışıldama yapar. Günümüzde tüplü televizyonların öncüsüdür. Tüpün ortasına bir delikli nesne yerleştirilse bu nesnenin görüntüsü gölge şeklinde tüpün sonunda oluşur.
Katot ışınlarının özellikleri:
Katot olarak kullanılan maddeye ve tüpteki gazın cinsine bağlı değildir.
Negatif elektrikle yüklüdürler.
Işınların hareket yönü katottan anota doğrudur.
Julius PLUCKER: Katot ışın tüpüne mıknatıs yaklaştırarak, katot ışınlarının magnetik alandaki davranışlarını inceleyen bilim adamıdır. Tüpü yeterince vakumlayamadığından başarılı olamamıştır.
Elektron Yükünün Bulunması
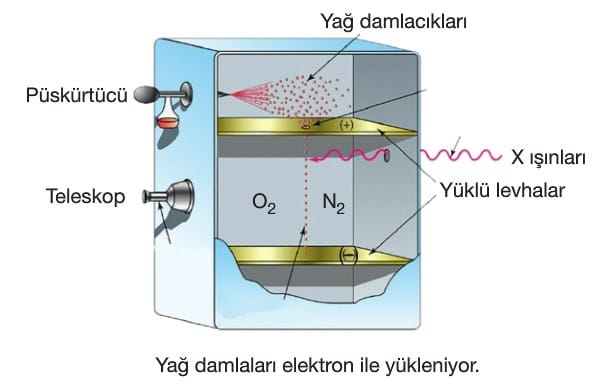
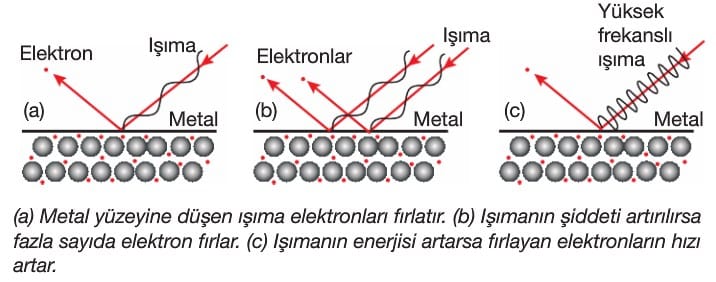
Yaptığı çalışmada küçük bir delikten geçen yağ damlaları azot ve oksijen bulunan ortama geçer. Burada gaz molekülleri üzerine gönderilen X—ışınları, gazları iyonlaştırarak elektronların serbest kalmasını sağlar. Serbest kalan elektronlar yağ damlaları tarafından tutulur. Rastgele miktarlarda tutulan elektronların elektriksel alandaki davranışlarından yola çıkarak elektronların yükü hesaplanmıştır.
Protonun Keşfi
Crookes tüpleri ile çalışma yapan Eugen Goldstein yaptığı çalışmalarda katot ışınlarından başka pozitif iyonların da ışıma yaptığını fark etti ve bu ışınlara kanal ışınları veya pozitif yüklü ışınlar adını verdi. Protonun yükünün elektron y ne eşit fakat işaretinin ters olduğu tespit edildi. Pozitif yüklü ışınlarda yük/kütle oranı atom numarası ile ters orantılı olarak artar bu yüzden en büyük yük/kütle oranı H+ iyonunda bulunur. H+ iyonunun kütlesi 1 olduğundan protonun yükü hesaplanmıştır.
Thomson Atom Modeli
- Atomun yapısında pozitif ve negatif yüklü tanecikler vardır.
- Atom, yarıçapı 10-8 cm olan küre şeklindedir ve protonlar ile elektronlar atomda rastgele dağılmışlardır.
- Atomların yapısındaki pozitif yük sayısı, negatif yük sayısına eşit olduğundan atomlar nötr taneciklerdir.
- Elektronların kütlesi ihmal edilecek kadar küçüktür. Bu yüzden atomun kütlesinin büyük bir kısmı pozitif yüklü taneciklerden oluşur.
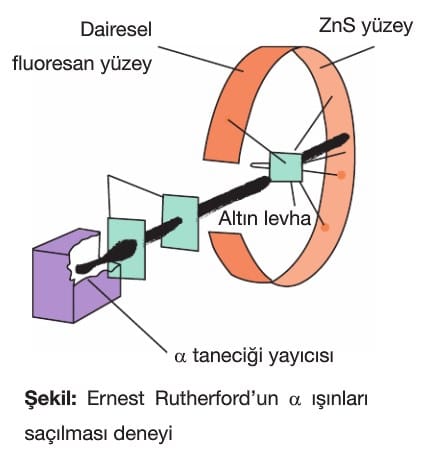
Rutherford Atom Modeli
- Bir atomdaki pozitif yükler çekirdek denilen çok küçük bir hacimde toplanmıştır.
- Pozitif yüklerin toplam kütlesi, atomun kütlesinin yaklaşık yarısı kadardır.
- Atoma gönderilen alfa parçacıklarının çok büyük bir kısmı sapmaya uğramadığına göre atom çoğunlukla boşluktan ibarettir.
- Elektronlar, atom çekirdeğinin etrafında bulunurlar ve protonlarla eşit sayıdadır.
Nötronun keşfi: 1932 yılında James Chadwick tarafından deneysel olarak varlığı kanıtlanmıştır. Yaptığı deneyde Berilyum atomunun α tanecikler ile bombardıman edilmesi sonucu kütlesi protondan fazla olan fakat elektriksel alandan sapmayan bir taneciğin varlığını keşfetmiştir ve bu taneciklere nötron adını vermiştir.
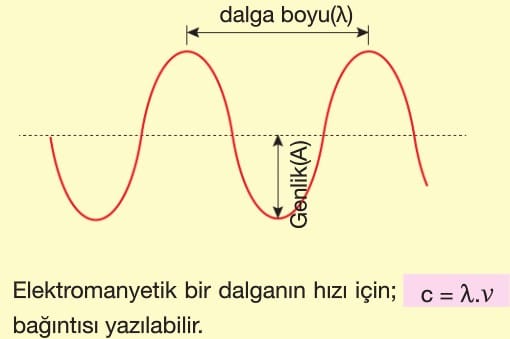
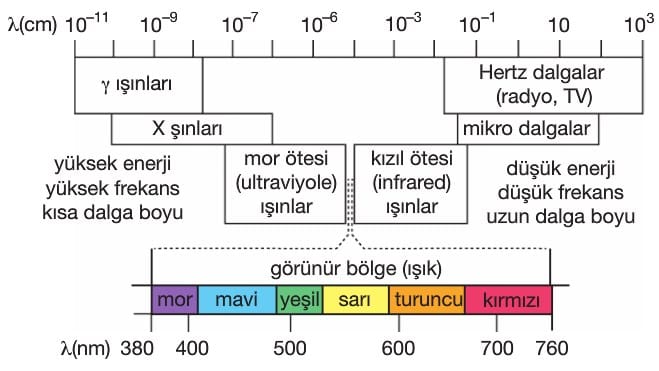
Görünür bölgedeki her renk bir dalga boyuna sahiptir. Tek bir dalga boyuna sahip olan ışığa monokromatik ışık, birden fazla dalga boyuna sahipse polikromaijk ışık denir. Kırmızı renk monokromatik, beyaz renk polikromatik ışık yayar. Beyaz ışık prizmadan geçirildiğinde farklı renklere ayrılır Renkler kırmızıdan mora kadar devam eder Prizmada mor renk en fazla kırınıma uğrarken, kırmızı renk en az kırınıma uğrar. Bunun nedeni dalga boyu ile kırınım ters orantılıdır. Dalga boyu kırmızıdan büyük ışınlara kızıl ötesi (|R); dalga boyu mordan kısa olan ışınlara mor ötesi (UV) ışınlar denir.
Bütün frekansları kapsayan elektromanyetik ışın dizinine elektromanyetik dalga spektrumu denir.
Bohr Atom Modeli
Bir atomda bulunan her elektron çekirdekten belli uzaklıktaki belirli enerjilere sahip yörüngelerde bulunurlar. Bu yörüngelere enerji düzeyi de denir. Çekirdekten uzaklaştıkça yörüngelerin potansiyel enerjileri artar. Yörünge numarası artıkça art arda gelen iki yörünge arasındaki potansiyel enerji farkı azalır. Çekirdeğe yakın yörüngelerde bulunan elektronların kinetik enerjisi ve hızı daha fazladır.
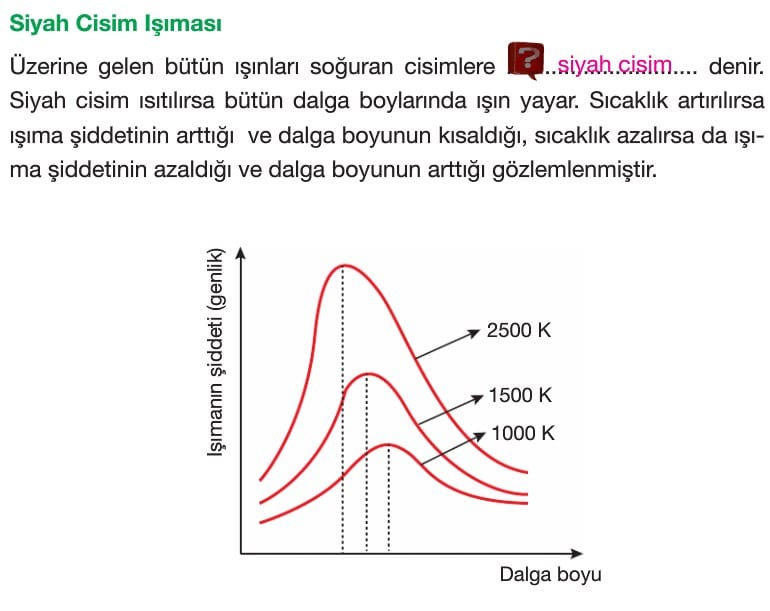
Bir atomun elektronları temel hal denilen en düşük enerji düzeyinde bulunmak isterler. Madde ısıtıldığında elektronlar daha yüksek enerjili düzeye geçer. Buna uyarılmış hal denir.
Elektronlar yüksek enerji düzeyinden düşük enerji düzeyine inerken aradaki enerji farkına eşit enerjide ışın yayılır.
Elektronların bulunduğu enerji seviyelerine K, L,M, N, O gibi harfler veya 1 , 2, 3, 4, 5 gibi rakamlarla gösterilebilir.
Bohr atom modeli tek elektronlu tanecikleri açıklamada başarılı olurken çok elektronlu tanecikleri açıklayamaz.