Asit ve Bazların Kuvveti 11. sınıf kimya
Kuvvetli Asitler
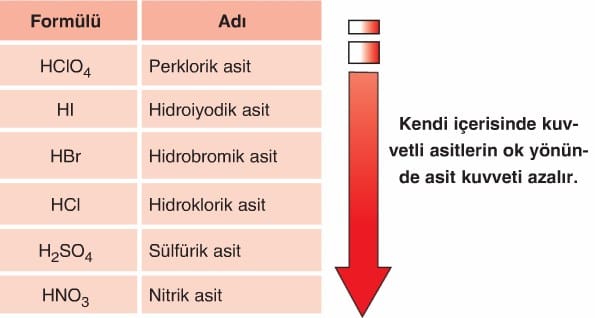
Suda çözündüğünde, çözünen moleküllerin % 100 iyonlaştığı kabul edilen asitlere kuvvetli asitler denir. Aşağıda kuvvetli olarak bilinen kuvvetli asitler verilmiştir.
- Asit kuvvetinin tesir değeriyle doğrudan bir ilişkisi yoktur.
- Kuvvetli asitlerin çözünme tepkimeleri tersinmez (tek yönlü) olarak kabul edilir.
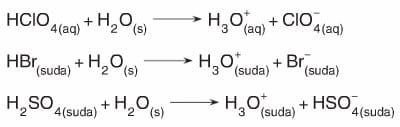
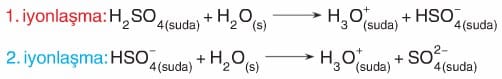
- H2SO4 iki tane hidrojen iyonu (H+) içeren (iki protonlu) bir asittir. İyonlaşmasının büyük bir kısmını 1 iyonlaşmada sağladığı için birinci iyonlaşma denklemi esas alınır.
Uyarı: Gerrçekte hiçbir asit suda çözündüğünde %100 iyonlaşmadığı bilinir. Ancak yukarıdaki tabloda verilen altı tane asitin %100 iyonlaştığı kabul edilir.
Zayıf Asitler
- Suda çözündüğünde moleküllerinin % 100’ü iyonlaşamayan (az bir kısmı iyonlaşan) asitlere zayıf asitler denir.
- Zayıf asitler suda tersinir (denge halinde) olarak iyonlaşırlar.
- Zayıf asitler, su (H2O) molekülleriyle denge oluştururlar.
- Zayıf asitlerin sulu çözeltilerinde oluşan denge karışımlarında,
-İyonlaşmamış zayıf asit molekülleri
-İyonlaşan asitlerin oluşturduğu hidronyum (H3O+) iyonları
-İyonlaşan asitten oluşan konjuge baz (anyonlar)
-Su (H2O) molekülleri ve çok az da olsa hidroksit (OH–) iyonları bulunur.
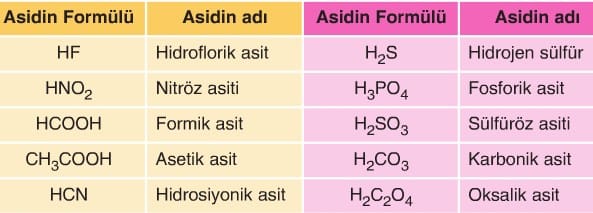
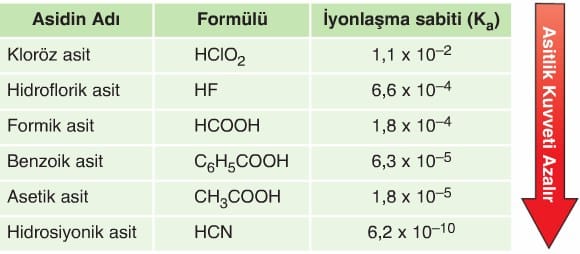
Aşağıda yaygın olarak kullanılan zayıf asitlerden bazıları verilmiştir.
- Bir protonu (H+) olan asitlere monoprotik asitler denir.
HCl, HI, HCN, HClO4, monoprotik asitlere örnek verilebilir. - Monoprotik asitler genel olarak HA formülüyle gösterilir. Bu formülde H hidrojen iyonunu, A– ise asidin anyonunu temsil etmektedir.
HA: Zayıf asit olsun
Bu asidin sudaki iyonlaşmasına ait olan denge tepkimesi aşağıdaki gibidir.
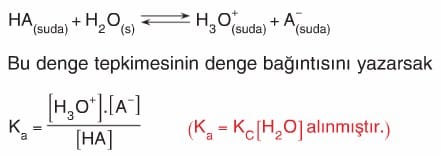
- Ka: Asidin iyonlaşma sabiti olarak adlandırılır. (KA olarak da gösterilir.)
- Ka aynı zamanda zayıf bir asidin iyonlaşma denge sabitidir.
- Ka nın sayısal değeri, bir zayıl asit için yalnızca sıcaklıkla değişir.
- Aynı sıcaklıkta bulunan HA zayıf asitlerinden Ka değeri büyük olanın asitlik kuvveti daha büyüktür.
- HA asidinin iyonlaşma yüzdesi ne kadar büyük olursa [H3O+] ve [A-] derişimleri o kadar büyük olur. Bu da Ka (asitlik iyonlaşma sabiti) değerinin büyük olması demektir.
- Sadece zayıf asitler için Ka değerinden bahsedilir. Kuvvetli asitlerde % 100 iyonlaşma olduğu kabul edildiğinden KA değerinden bahsedilmez.
Aşağıdaki tabloda bazı zayıf asitler ve 25 °C’deki asitlik sabitleri verilmiştir.
Kuvvetli Bazlar
Suda çözündüğünde, çözünen moleküllerin % 100 iyonlaştığı kabul edilen bazlara kuvvetli bazlar denir.
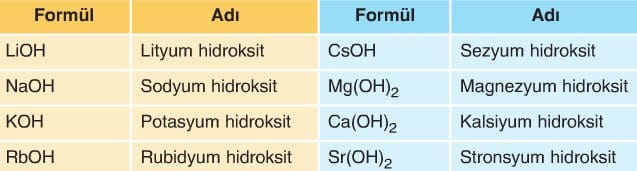
Aşağıdaki tabloda bilinen kuvvetli bazlar verilmiştir.
- Alkali metallerin hidroksitleri, toprak alkalilere göre daha kuvvetlidir.
- IA ve IIA gruplarında aşağı doğru inildikçe bazlık kuvveti artar.
Zayıf Bazlar
Suda çözündüğünde moleküllerinin % 100’ü iyonlaşamayan (az bir kısmı iyonlaşan) bazlar zayıf bazlar denir.
- Zayıf bazlar suda tersinir (denge halinde) olarak iyonlaşır.
- Zayıf bazların sulu çözeltilerinde oluşan denge karışımlarında,
-İyonlaşmış zayıf baz molekülleri
-İyonlaşan bazın oluşturduğu hidroksit (OH–) iyonları
-İyonlaşan bazdan oluşan konjuge asit katyonları
-Su molekülleri ve çok azda olsa hidronyum (H3O+) iyonları bulunur.
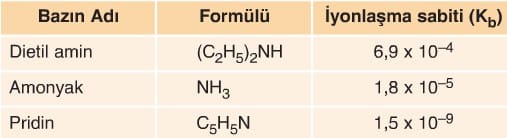
Aşağıda çok bilinen bazı zayıf bazlar verilmiştir.

- Bir zayıf baz olan NH3 ün sudaki iyonlaşma denklemi ve denge bağıntısı aşağıdaki gibidir.
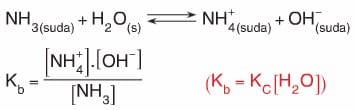
- Kb baz iyonlaşma sabiti olup, sayısal değeri sadece sıcaklık ile değişir.
- Kb değeri ne kadar küçükse bazın iyonlaşma yüzdesi o kadar küçük ve kuvveti o kadar azdır.
25 0C’de bazı zayıf bazlar ve iyonlaşma sabitleri (Kb) verilmiştir.
Asit ve Bazların Kuvveti video 11. sınıf Kimya Adası