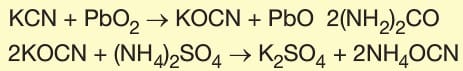Organik ve Anorganik (İnorganik) Bileşikler Kimya Ayt
ANORGANİK VE ORGANİK BİLEŞİKLER
Organik Kimyaya Giriş
19.yy. başlarında organik maddeleri yalnızca organizmaların üretebileceği ve cansız maddelerin ise üretemeyeceğine inanılıyordu.
1828’de Friedrich Wöhler anorganik maddeden organik madde üreten ilk bilim adamıdır.
Potasyum siyanürden önce potasyum siyanatı daha sonra da üreyi elde etmiştir.
Organik kelimesini ilk ortaya atan bilim insanı 1807 yılında Berzelius’tur. Organik bileşikler ancak yaşamın gücü (vitalizm) ile canlı organizmalarda oluşabilir.
Organik maddeler
Organik maddelerin yapısında C elementi ve çoğunlukla H elementi bulunur. Bu elementlerin haricinde O,S,P ve Halojen gibi başka elementler de bulunabilir.
C ve H atomları organik bileşiğin temel elementleridir. Bu elementlerin yanında diğer elementlerde varsa bunlara hetero atomlu bileşikler denir. Yapısında C bulunduran her bileşik organik yapıda değildir.
Anorganik maddeler
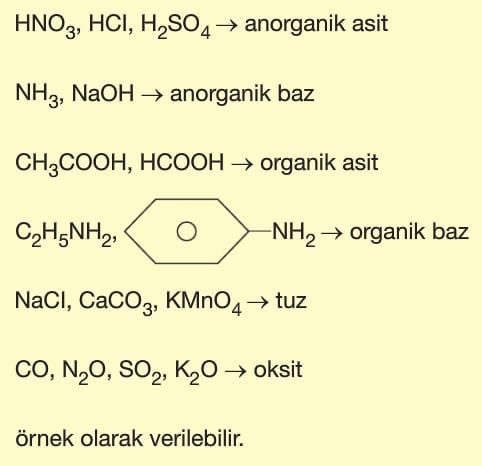
Asitler, Bazlar, Tuzlar, Oksitler anorganik bileşiklerdir. Bu genellemeye uymayan bazı asit ve bazlar vardır.
Organik ve Anorganik Bileşikler Arası Farkları
Organik bileşiklerin ana kaynağı canlılar ve fosilleşmiş maddelerdir. Anorganik maddeler ise mineral ve cevherlerden elde edilir.
Organik bileşikler yanıcı, anorganik bileşikler genelde yanmaz.
Anorganik bileşiklerin erime ve kaynama noktaları organik bileşiklere göre genellikle yüksektir.
Organik bileşikler genel olarak kovalent bağlı, anorganik bileşikler iyonik bağlıdır.
Organik bileşikler anorganik bileşiklere göre daha yavaş tepkime verir.
Anorganik bileşiklerde organik bileşiklere göre kimyasal tepkimelerdeki entalpi değişimi daha fazladır.
Organik bileşiklerin kendilerine has kokuları vardır. Anorganik bileşikler genellikle kokusuzdur.
Karbon 4 bağ yapabildiğinden dolayı organik bileşiklerin sayısı anorganik bileşiklere göre daha çoktur.
Basit Formül ve Molekül Formülü Bulma
Bir bileşikteki elementlerin molce birleşme oranına bileşiğin basit formülü denir. NH3’te N’mol sayısının H mol sayısına oranı 1/3’tür.
a. Bileşiğin Birleşme Oranı Kullanarak Basit Formül Bulma
Bir bileşiğin birleşme oranı verildi ise, bu oran yardımı ile elementlerin mol sayısı oranı bulunur. Bulunan bu oran bileşiğin basit formülüdür.
b. Kimyasal Tepkime Kullanarak Basit Formül Bulma
Bir organik bileşiğin kimyasal tepkimesi kullanılarak da basit formülü bulunabilir.
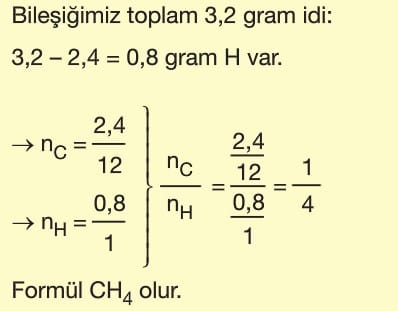
Örneğin 3,2 gramı yakılınca 8,5 gram karbondioksit oluşturan hidrokarbonun formülünü bulalım:
(H=1, C=12, O=16)