Kovalent Bağ Ve Lewis Elektron Gösterimi 9.Sınıf Kimya
Kovalent Bağ
» Ametal atomlarının kendi aralarında elektron ortaklaşması ile oluşturduğu bağ türüne kovalent bağ denir.
» Aynı ametaller arasında molekül yapılı elementler oluşur. H2 , O2, F2, Cl2 gibi.
» Farklı ametaller arasında molekül yapılı bileşikler oluşur. (H2O, NH3 , … gibi) Molekül yapılı bileşiklere kovalent bileşik de denir.
Kovalent bağ, iyonik bağa göre daha zayıftır.
Kovalent Bağ İçeren Moleküllerde Lewis Gösterimi
Kovalent moleküllerde ,
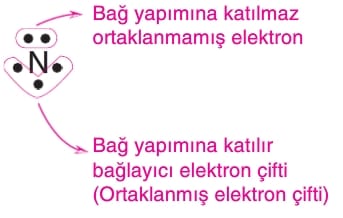
» Bağ yapımına katılmış elektron çiftine bağlayıcı elektron (ortaklanmış elektron) çifti denir.
» Bağ yapımına katılmayan elektron çiftine ise ortaklanmamış elektron çifti denir.
Apolar Kovalent Bağ ve Molekülün Lewis Yapısı
» Aynı ametal atomları arasında elektron ortaklaşması sonucu apolar kovalent bağ oluşur.
BİR YORUM YAZIN
ZİYARETÇİ YORUMLARI - 3 YORUM
Çok teşekkürler proje ödevimde kullanacağım
Çok teşekkür ederim çok güzel olmuş
Çok teşekürler.