Kimyasal Denge 11. sınıf kimya
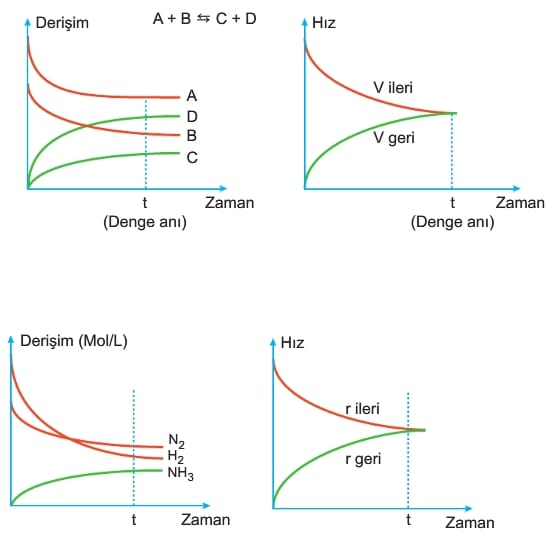
KİMYASAL DENGE
- Maksimum düzensizlik ve minimum enerjiye eğilim zıt yöndedir.
- İleri hız ve geri hız eşittir.
- Madde derişimleri sabittir.
- Tepkimeye giren maddeler asla bitmez.
- Sıcaklık sabittir.
- Kapalı sistemlerde gerçekleşirler.
Homojen Denge
Girenlerin ve ürünlerin birbiri içerisinde çözünebildiği denge tepkimelerine denir.
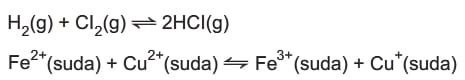
Heterojen Denge
Denge tepkimesindeki maddelerden en az biri farklı fiziksel halde olan tepkimelerdir.
![]()
Fiziksel Denge
Fiziksel dengenin en güzel örneği sabit sıcaklıkta su buharı ile su arasındaki dengededir. Buhar belirli bir doygunluğa ulaştığında buharlaşan ve sıvılaşan tanecik sayıları eşitlenir.
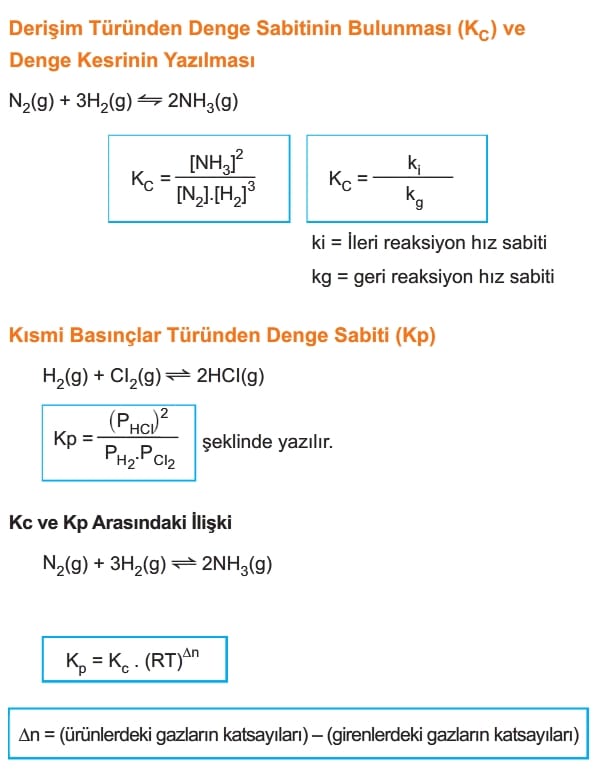
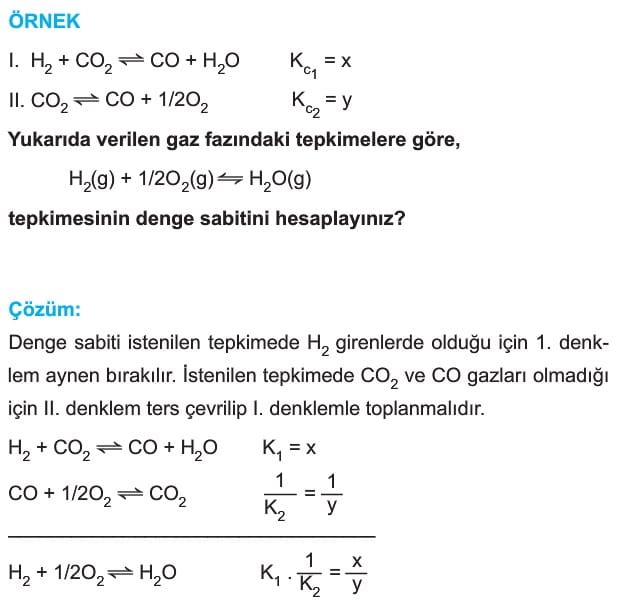
HESS Yasası ve Denge Tepkimelerinde Uygulanması
Tepkime ters çevrildiğinde denge sabitinin çarpmaya göre tersi alınır.
Tepkime bir sayı ile çarpılır ise çarpılan sayısı denge sabitine üstel olarak yazılır.
İki denklem toplanır ise denge sabitleri çarpılır.
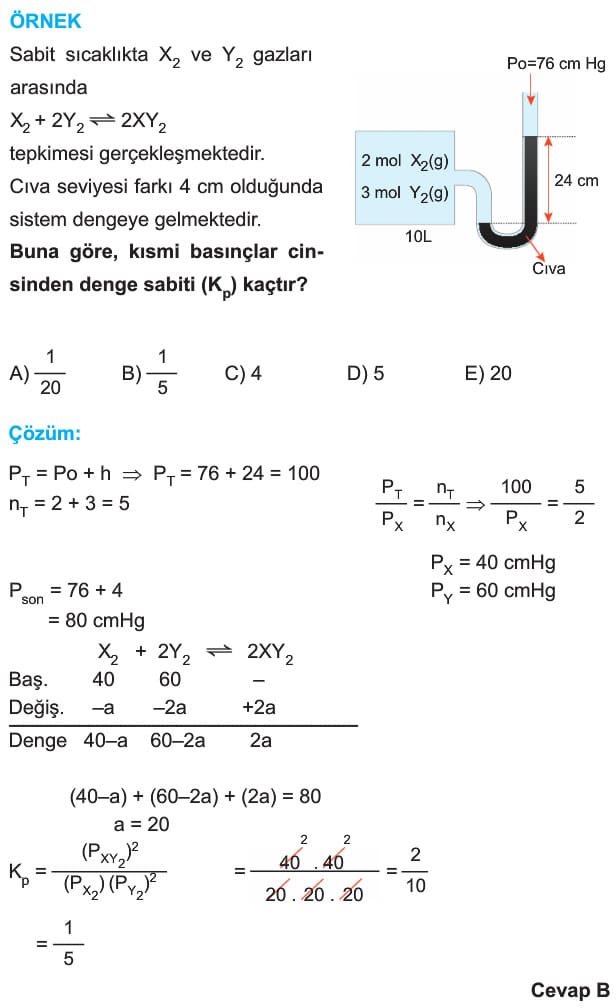
Anlık Denge Sabiti (Ki veya Qc)
Bir tepkimenin herhangi bir anında ortamdaki maddelerin denge bağıntısında yerine yazılması ile hesaplanan değere denir.
- Qc > Kc ise sistem dengeye ulaşmıştır.
- Qc < Kc ise sistem dengeye ulaşmamıştır. Tepkime ürünler yönünde hareket eder.
- Qc > Kc ise sistem dengeye ulaşmamıştır. Ürün miktarı fazla olduğu için tepkimeye girenler yönünde hareket eder.
Kimyasal Denge Soruları ve Çözümleri
Çözümlü Örnek Test Soruları
Kimyasal Denge
Kimyasal denge, tersinir tepkimelerde ileri ve geri reaksiyonların hızlarının eşit olduğu durumu ifade eder. Bu durumda reaktanlar ve ürünlerin derişimleri sabit kalır. Denge sabitleri (Kc ve Kp), tepkimenin dengeye ulaştığında reaktanlar ve ürünler arasındaki ilişkiyi gösterir.
1. Aşağıdaki ifadelerden hangisi kimyasal dengeye ulaşmış bir tepkime için doğrudur?
A) Reaktanların tamamı ürünlere dönüşmüştür.
B) İleri ve geri tepkimenin hızları eşittir.
C) Ürünlerin miktarı reaktanların miktarından her zaman fazladır.
D) Kimyasal dengeye ulaşıldığında tepkime durur.
Çözüm: Kimyasal dengeye ulaşıldığında ileri ve geri tepkimelerin hızları eşitlenir, ancak tepkime devam eder. Cevap B.
2. Aşağıda verilen denge tepkimesi için denge sabiti (Kc) ifadesi nedir?
N2(g) + 3 H2(g) = 2 NH3(g)
A) Kc = ([N2][H2]^3) / [NH3]^2
B) Kc = ([NH3]^2) / ([N2][H2]^3)
C) Kc = [NH3] / ([N2][H2])
D) Kc = ([N2][H2]) / [NH3]^2
Çözüm: Denge sabiti (Kc), ürünlerin derişimlerinin reaktanların derişimlerine oranı olarak ifade edilir. Bu durumda, Kc = ([NH3]^2) / ([N2][H2]^3). Cevap B.
3. Aşağıdaki denge tepkimelerinden hangisinin denge sabiti (Kc) değeri yüksekse, ürünlerin miktarının reaktanlara göre daha fazla olduğu söylenebilir?
A) Kc = 1
B) Kc = 0,1
C) Kc = 10
D) Kc = 100
Çözüm: Denge sabiti (Kc) ne kadar büyükse, ürünlerin miktarı reaktanlara göre o kadar fazladır. Bu nedenle Kc = 100 en büyük ürün derişimine işaret eder. Cevap D.
4. Denge sabiti Kc, sıcaklık değiştirildiğinde nasıl etkilenir?
A) Kc sabit kalır, sadece reaktan ve ürünlerin miktarı değişir.
B) Kc sadece egzotermik tepkimelerde değişir.
C) Kc sadece endotermik tepkimelerde değişir.
D) Kc sıcaklık değişimi ile değişir.
Çözüm: Denge sabiti (Kc) yalnızca sıcaklık değiştiğinde değişir. Sıcaklık değişimi, ileri ve geri tepkimelerin hızını etkiler. Cevap D.
5. 2 SO2(g) + O2(g) = 2 SO3(g) tepkimesinde, başlangıçta sadece SO2 ve O2 varsa ve dengeye ulaşıldığında SO3 oluşuyorsa bu denge durumu nasıl açıklanır?
A) İleri tepkimenin hızı geri tepkimeden daha hızlıdır.
B) Dengeye ulaşmadan önce reaktanlar sürekli azalır.
C) İleri ve geri tepkimenin hızları eşittir, ancak sistem dengeye ulaşmıştır.
D) Denge sabiti çok küçük olduğu için ürünler çok azdır.
Çözüm: Kimyasal dengeye ulaşıldığında ileri ve geri tepkimenin hızları eşit olur. Ancak başlangıçta ürün oluşumu gözlenir. Cevap C.
6. Aşağıdaki durumların hangisinde denge sabiti (Kp) kullanılır?
A) Sadece gaz fazında gerçekleşen tepkimelerde
B) Katı maddelerin bulunduğu tepkimelerde
C) Sıvı çözeltilerde
D) Reaksiyonun hızı ölçülürken
Çözüm: Denge sabiti Kp, gaz fazındaki tepkimelerde kısmi basınçlarla ilgilidir. Cevap A.