Gerçek Gazlar 11. Sınıf Kimya
İdeal gazı açıklarken kinetik teoriden yararlandık. Burada iki temel unsur vardır.
- Gazların hacmi kabın hacmi yanında ihmal edilir.
- Gaz tanecikleri arasındaki çekim sıfır kabul edilir.
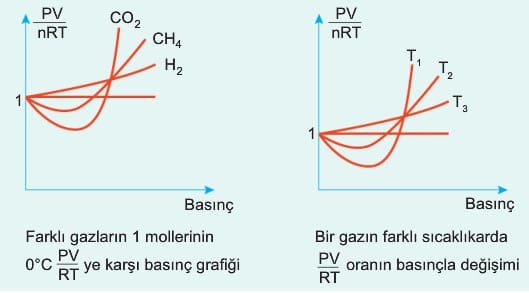
Gazların sıcaklığını düşürüp basıncını artırdığımızda bu kabuller gerçekliğini yitirir ve gazlar birbirlerini çekmeye başlarlar. Örneğin Boyle kanununa göre 1 atm olan gaz basıncını 2 atm yapmak için hacmini yarıya indirmek yeterlidir; ancak gazın basıncını 200 atm den 400 atm ye çıkarmak istediğimizde hacmi yarıya indirmek yetmeyecektir. Aynı durumu sıcaklık için de söyleyebiliriz. Gazın sıcaklığı 400 °K den 200 °K sıcaklığına düşürüldüğünde basıncı yarıya indirebiliriz; ancak sıcaklığı 40 °K den 20 °K sıcaklığına düşürüldüğünde basınç yarıya inmez; çünkü tanecikler arası etkileşim arttığı için hesaplanan değer ideal gaz denkleminde bulunandan farklı olacaktır.
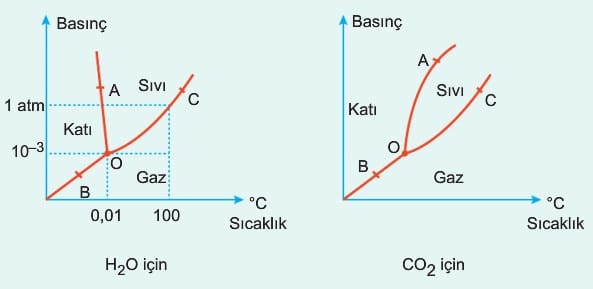
MADDENİN ÜÇLÜ FAZ DİYAGRAMI
Basınç ve sıcaklığa bağlı olarak maddenin üç fiziksel halini gösteren granktir. Burada, H2O gibi donarken hacmi artan maddelerde erime noktasının basınçla azaldığı görülür.
H2O nun faz diyagramı incelendiğinde O noktasında H2O nun üç fiziksel hali aynı anda görülür.
O – A eğrisi suyun erime veya donma eğrisidir. Bu eğride basınç artıkça erime noktasının azaldığını görebiliriz. Bu eğri boyunca katı – sıvı dengesi vardır. Bu durum, antimon, bizmut ve galyum elementleri içinde görülür. Örneğin 0°C de buz 19,63 cm3 hacim kaplar. Dış basıncın artması donmayı ve hacim artışını engeller. Bu nedenle donma olayı daha düşük sıcaklıkta gerçekleşir.
O – B eğrisi katı – gaz dengesinin olduğu eğriyi ifade eder. Bu eğrinin herhangi bir noktasında sıcaklık artırıldığında süblimleşme gerçekleşirken sıcaklık azaltılır ise su için kırağılaşma diğer maddeler için desüblimleşme (depozisyon) gerçekleşmiş olur.
O – C eğrisi sıvı – buhar dengesinin olduğu eğridir. Bu eğri üzerindeki herhangi bir basınca karşılık gelen sıcaklık suyun kaynama sıcaklığını gösterir.
Aynı durum karbon dioksit için de geçerlidir. Aradaki tek fark donma olayının gerçekleştiği A – O eğrisi boyunca donma noktasının basınçla artması durumudur. İki grafik için de basınç belli bir değerin altında ise bu madde sıvı fazda görülemez; belli bir değerin üzerinde ise de süblimleşme olayı gerçekleşmez. Örneğin CO2 kuru buz katısına uygulanan basınç 5,11 atm nin üzerinde ise süblimleşmez. Bu basıncın altında da sıvı halde bulunmaz. Kolay süblimleşen maddelere naftalin (C10H8) ve iyot (I2(k)) örnek verilebilir.
Gaz – Buhar ve Kirik Sıcaklık
Bulunduğu sıcaklıkta hiçbir basınç altında sıvılaşmayan maddelere gaz denir. Bulunduğu sıcaklıkta basınç artışı ile sıvılaşabilen maddelere buhar denir. Her buharın sıvılaşabileceği maksimum bir sıcaklığı vardır. Bu sıcaklığa kritik sıcaklık denir. Maddenin sıcaklığı kritik sıcaklıktan fazla ise ne kadar basınç uygulanırsa uygulansın sıvılaşmaz.
JOULE – THOMSON OLAYI
Gazların ortam sıcaklığından daha düşük sıcaklıklara soğutulması ile ilgili çalışmayı James Joule ve William Thomson yapmıştır. Yaptıkları deney sonucunda ısıca yalıtkan bir silindirde hızla genleştirilen bazı gazların sıcaklığının değişmediğini, bazı gazların sıcaklığının düştüğünü, bazı gazların sıcaklığının arttığını gözlemlemişlerdir. Genleştirilen gazda moleküller arası gaz çekim kuvvetinin yenilmesi için gereken enerji kendi özısılarından karşılandığı için hızla genleşirken gaz soğumaktadır. Gaz soğuduğunda bulunduğu ortamı da soğutmaktadır. Bu olaya Joule – Thomson genleşmesi denir. Buzdolaplarındaki soğutma sistemi bu genleşmeye dayanır.
SOĞUTMA AKIŞKANLARI
Buharlaşırken ortamdan ısı alarak ortamı soğutan maddelere soğutucu akışkanlar denir. Soğutucu akışkanlar,
- Normal kaynama noktası düşük olmalıdır.
- Çevre dostu ve ekonomik olmalıdır.
- Tepkime vermemeli, yanıcı ve zehirleyici olmamalıdır.
- Uygulanabilir basınç altında buharlaşmalı ve sıvılaşmalıdır.
- Kritik sıcaklığı yüksek olmalıdır.
- Enerji tüketimi az olmalıdır.
- Oda koşullarında buhar halinde olmalı
özelliklerine sahip olmalıdır.
Gerçek Gazlar Soruları ve Çözümleri
Çözümlü Örnek Test Soruları
Gerçek Gazlar
Gerçek gazlar, ideal gaz yasalarına uymayan gazlardır. Moleküller arası etkileşimler ve gazların belirli bir hacme sahip olmaları, gerçek gazların davranışlarını ideal gazlardan ayırır. Bu nedenle, Van der Waals denklemi gibi düzeltilmiş denklemler kullanılır.
1. Gerçek gazların ideal gazlardan sapmasına neden olan faktörler nelerdir?
A) Moleküller arası etkileşimler ve moleküllerin hacmi
B) Gazın sıcaklığının yüksek olması
C) Gazın basıncının düşük olması
D) Gazın yoğunluğunun düşük olması
Çözüm: Gerçek gazlar, moleküller arası çekim kuvvetleri ve moleküllerin belirli bir hacmi olduğu için ideal gazlardan saparlar. Cevap A.
2. Hangi koşullarda gazlar, ideal gaz yasasına en çok uyarlar?
A) Yüksek sıcaklık ve düşük basınç
B) Düşük sıcaklık ve yüksek basınç
C) Yüksek sıcaklık ve yüksek basınç
D) Düşük sıcaklık ve düşük basınç
Çözüm: Gazlar, yüksek sıcaklık ve düşük basınç koşullarında ideal gaz yasasına en çok uyarlar. Bu koşullarda moleküller arası etkileşimler ve hacim etkisi ihmal edilebilir. Cevap A.
3. Van der Waals denklemi, ideal gaz yasasına göre hangi iki önemli düzeltmeyi içerir?
A) Basınç ve sıcaklık
B) Moleküller arası çekim kuvveti ve moleküllerin hacmi
C) Hacim ve sıcaklık
D) Moleküllerin kütlesi ve sıcaklık
Çözüm: Van der Waals denklemi, ideal gaz yasasında moleküller arası çekim kuvveti ve moleküllerin hacmini hesaba katan iki önemli düzeltme yapar. Cevap B.
4. Aşağıdaki gazlardan hangisi, düşük sıcaklık ve yüksek basınçta ideal gaz yasasından en fazla sapma gösterir?
A) Helyum
B) Hidrojen
C) Amonyak
D) Neon
Çözüm: Amonyak (NH₃) gibi polar moleküller, moleküller arası çekim kuvvetleri nedeniyle ideal gaz yasasından sapma gösterir. Cevap C.
5. Van der Waals sabitlerinden “a” ve “b” sabitleri neyi ifade eder?
A) “a” sabiti, gazın sıcaklıkla ilişkisini; “b” sabiti, gazın moleküler hacmini ifade eder.
B) “a” sabiti, moleküller arası çekim kuvvetini; “b” sabiti, gaz moleküllerinin kapladığı hacmi ifade eder.
C) “a” sabiti, gazın kütlesini; “b” sabiti, moleküller arası çekim kuvvetini ifade eder.
D) “a” sabiti, gazın yoğunluğunu; “b” sabiti, gazın hacmini ifade eder.
Çözüm: Van der Waals denklemi düzeltmelerinde “a” sabiti moleküller arası çekim kuvvetlerini, “b” sabiti ise gaz moleküllerinin kapladığı hacmi temsil eder. Cevap B.
6. Gerçek gazların ideal gazlardan en fazla sapma gösterdiği koşullar hangileridir?
A) Düşük basınç ve yüksek sıcaklık
B) Yüksek basınç ve düşük sıcaklık
C) Yüksek basınç ve yüksek sıcaklık
D) Düşük basınç ve düşük sıcaklık
Çözüm: Gerçek gazlar, yüksek basınç ve düşük sıcaklık koşullarında ideal gaz yasasından en fazla sapma gösterirler. Cevap B.







Çok beğendim bu siteyi, çok faydalı tavsiye ederim
Tam aradığım bilgi teşekkürler eokultv.
Hayat zor doguda okuyan icin daha zor burda simdi birde uzaktan egitim var evet belki batidakilwr icin guzel ama bir de dogudakilari dusunu sayin bakanim kararlar aliyorsunuz ama sadece batinin cikari icib aliyorsunuz lutfen dogudakil ogrencileride dusunun