Dipol-İndüklenmiş Dipol Etkileşimi 9. Sınıf Kimya
Dipol-İndüklenmiş Dipol Etkileşimi, polar bir molekülün (dipol), apolar bir molekülü (indüklenmiş dipol) etkilemesi sonucu oluşan zayıf bir moleküller arası kuvvettir. Bu etkileşim, moleküller arası etkileşimler arasında önemli bir yere sahiptir. 9. sınıf kimya müfredatında bu etkileşim türü, moleküller arası kuvvetlerin daha iyi anlaşılmasını sağlar.
Dipol – İndüklenmiş Dipol Etkileşimi
Polar bir molekül, apolar bir moleküle veya soy gaz atomuna yeterince yaklaştığında, polar moleküldeki elektrik yüklerinin etkisiyle apolar molekülde geçici bir kutuplaşma meydana gelir. Bu durumda, apolar molekülün bir tarafı kısmen artı (δ⁺) ve diğer tarafı kısmen eksi (δ⁻) yük kazanır. Bu geçici kutuplaşmaya indüklenmiş dipol denir. İndüklenmiş dipol ile polar molekül arasında oluşan bu etkileşim, elektrostatik çekim kuvvetlerine dayanır ve dipol – indüklenmiş dipol etkileşimi olarak adlandırılır.
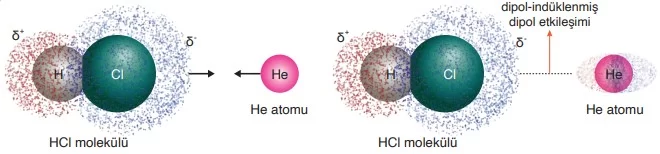
Bu tür etkileşimler, genellikle polar moleküller ile soy gazlar veya apolar moleküller arasında görülür. Örneğin, su (H₂O) ile iyot (I₂) veya karbon tetraklorür (CCl₄) gibi apolar moleküller arasında dipol – indüklenmiş dipol etkileşimleri oluşur. Bu etkileşimler, özellikle apolar moleküllerin çözücülerde çözünmesinde önemli bir rol oynar.
Ayrıca, bu tür etkileşimler genellikle zayıf olup, van der Waals kuvvetleri kapsamına girer. Bu nedenle, indüklenmiş dipol etkileşimlerinin yoğunluğu, moleküller arasındaki mesafeye ve moleküllerin boyutlarına bağlı olarak değişiklik gösterebilir.
Çözümlü Örnek Sorular
Soru 1
Dipol-indüklenmiş dipol etkileşimi hangi iki tür molekül arasında oluşur?
A) İki polar molekül
B) İki apolar molekül
C) Bir polar ve bir apolar molekül
D) İki iyonik molekül
Çözüm:
Dipol-indüklenmiş dipol etkileşimi, bir polar molekülün, yakınındaki apolar bir molekülü geçici olarak dipol yapmasıyla oluşur.
Doğru cevap: C
Soru 2
Aşağıdaki moleküllerden hangisi dipol-indüklenmiş dipol etkileşimine örnek olarak verilebilir?
A) HCl ve O2
B) H2O ve NH3
C) Cl2 ve N2
D) CH4 ve CO2
Çözüm:
HCl polar bir moleküldür ve O2 ise apolar bir moleküldür. HCl, O2 üzerinde geçici bir dipol oluşturabilir ve dipol-indüklenmiş dipol etkileşimi gerçekleşir.
Doğru cevap: A
Soru 3
Dipol-indüklenmiş dipol etkileşiminin kuvveti hangi faktöre bağlıdır?
A) Apolar molekülün büyüklüğüne
B) Polar molekülün polaritesine
C) Moleküller arası mesafeye
D) Yukarıdakilerin hepsi
Çözüm:
Dipol-indüklenmiş dipol etkileşiminin kuvveti, apolar molekülün büyüklüğüne, polar molekülün polaritesine ve moleküller arası mesafeye bağlıdır. Bu etmenler etkileşimin gücünü belirler.
Doğru cevap: D
Soru 4
Dipol-indüklenmiş dipol etkileşimi ile ilgili olarak aşağıdakilerden hangisi doğrudur?
A) Kalıcı dipoller arasında oluşur
B) Sadece apolar moleküller arasında görülür
C) Geçici dipoller arasında oluşur
D) Polar bir molekülün, apolar bir molekülü etkilemesiyle oluşur
Çözüm:
Dipol-indüklenmiş dipol etkileşimi, polar bir molekülün apolar bir molekülü geçici olarak dipol yapmasıyla oluşur.
Doğru cevap: D
Soru 5
Dipol-indüklenmiş dipol etkileşimlerinin en güçlü olduğu durum aşağıdakilerden hangisidir?
A) Küçük moleküller arasında
B) Büyük moleküller arasında
C) Moleküller arası mesafenin büyük olduğu durumlarda
D) Polaritenin zayıf olduğu moleküller arasında
Çözüm:
Büyük apolar moleküller, polar moleküller tarafından daha kolay dipol haline getirilir. Bu nedenle büyük moleküller arasında dipol-indüklenmiş dipol etkileşimleri daha güçlüdür.
Doğru cevap: B