Lewis Nokta Yapısı 9. Sınıf Kimya
Lewis nokta yapısı, atomların değerlik elektronlarını göstermek ve kimyasal bağların nasıl oluştuğunu açıklamak için kullanılan bir gösterim yöntemidir. 9. sınıf kimya müfredatında Lewis yapısı, elementlerin elektron dizilimlerini ve bağ yapma eğilimlerini anlamak için öğretilir. Bu yöntem, atomların kimyasal bağ oluştururken nasıl elektron paylaştığını ya da elektron aldığı/verdiğini görsel olarak temsil eder.
LEWIS NOKTA YAPISI
Atomlar bileşik oluştururken soy gazların elektron dizilimine benzemek isterler. Atomların son katmanlarındaki elektronlara valans elektronları denir.
Dublet Kuralı
Atomların kararlı hale gelmek için son katmanlarındaki elektron sayısını 2He gibi ikiye benzetmesine denir.
Oktet Kuralı
Atomların kararlı hale ulaşmak için soy gazlardan 10Ne, 18Ar gibi diğer gazlara sekize benzetilmesi kuralıdır.
- Periyodik tabloda IA, IIA ve IIIA grubunda yer alan elementler (H hariç) son katmanlarındaki elektronlarını vererek pozitif değerlik alırlar.
- IVA, VA, VIA ve VIIA grubundaki ametaller ise bileşik oluştururken elektronlarını ortak kullanarak negatif ya da pozitif değerlik alabilirler. Ametaller bileşik oluştururken son katmandaki elektronları ortaklaşa kullanırlar.
- Atomlar bileşik oluştururken güçlü etkileşimler meydana gelir. Güçlü etkileşimlerle atomların son katmanlarındaki elektronlar devreye girer. Bunu göstermek için Lewis noktası yapısı kullanılır.
- Lewis yapısı adımları aşağıdaki gibidir:
Elementin katman elektron dizilimi yazılır.
Son katmandaki değerlik elektron sayısı belirlenir.
Elementin sembolü yazılır.
Element sembolünün etrafına değerlik elektronları yerleştirilir.
Atomların Lewis Nokta Yapısı
8O Oksijen Atomunun elektron dizilimi: O: 1s2 2s2 2p4
- Değerlik elektron sayısı: 6
- Lewis yapısı: :

Magnezyum Atomunun elektron dizilimi: Mg: 1s2 2s2 2p6 3s2
- Değerlik elektron sayısı: 2
- Lewis yapısı: Mg .
Kükürt Atomunun elektron dizilimi: 1s2 2s2 2p6 3s2 3p4
- Değerlik elektron sayısı: 6
- Lewis yapısı:

Helyum Atomunun Lewis Yapısı:
- Katman elektron dizilimi: 1s2
- Değerlik elektron sayısı: 2
- Lewis yapısı: He :
Not: Helyum soy gaz olduğundan iki değerlik elektronu bağ yapmaz, bu yüzden elektronları yan yana yazmak daha doğru olur.
Moleküllerin Lewis Nokta Yapısı
- Moleküller, aynı ya da farklı ametallerin bir araya gelmesiyle oluşabilir.
- Aynı ametal atomlarının bağ yapmasıyla element molekülleri, farklı ametal atomlarının bağ yapmasıyla ise bileşik molekülleri meydana gelir.


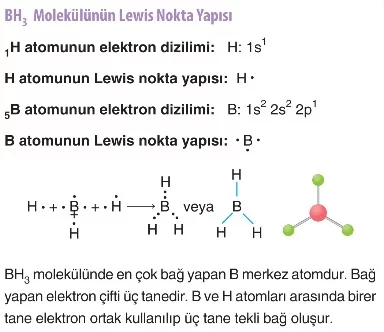
Çözümlü Örnek Sorular
Soru 1:
Lewis nokta yapısına göre H₂ molekülü nasıl çizilir?
A) H : H
B) H – H
C) H : O
D) H – O
Çözüm:
Hidrojen (H) atomu tek bir valans elektronu taşır. H₂ molekülünde iki hidrojen atomu birer elektronu paylaşarak tek bir bağ oluşturur. Bu nedenle Lewis yapısında H : H şeklinde gösterilir.
Sonuç: A) H : H
Soru 2:
Oksijen (O₂) molekülünün Lewis nokta yapısı nasıldır?
A) O – O
B) O :: O
C) O : O
D) O = O
Çözüm:
Oksijen atomu 6 valans elektronu taşır ve O₂ molekülünde iki oksijen atomu arasında iki çift elektron paylaşılır, bu da çift bağ anlamına gelir. Lewis yapısında O :: O şeklinde gösterilir.
Sonuç: B) O :: O
Soru 3:
Karbon dioksit (CO₂) molekülünün Lewis nokta yapısı nasıldır?
A) O :: C :: O
B) O : C : O
C) O = C = O
D) O – C – O
Çözüm:
CO₂ molekülünde karbon atomu iki oksijen atomu ile çift bağ yapar. Lewis nokta yapısında bu çift bağlar O = C = O şeklinde gösterilir.
Sonuç: C) O = C = O
Soru 4:
Aşağıdaki bileşiklerden hangisinin Lewis nokta yapısı iki çift bağ içerir?
A) H₂O
B) O₂
C) CO
D) N₂
Çözüm:
O₂ molekülünde her iki oksijen atomu iki çift elektronu paylaşarak çift bağ yapar. Bu nedenle Lewis nokta yapısında iki çift bağ bulunur.
Sonuç: B) O₂
Soru 5:
H₂O molekülünde oksijen atomunun Lewis nokta yapısı kaç elektron çifti içerir?
A) 1
B) 2
C) 4
D) 6
Çözüm:
H₂O molekülünde oksijen atomu iki bağ yapar ve geri kalan 2 elektron çifti bağ yapmadan kalır. Toplamda oksijen atomunun çevresinde 2 bağ yapan çift ve 2 yalnız çift bulunur, yani toplamda 4 elektron çifti vardır.
Sonuç: C) 4