Elektroliz Nedir Kullanım Alanları Kimya Ayt
Elektroliz
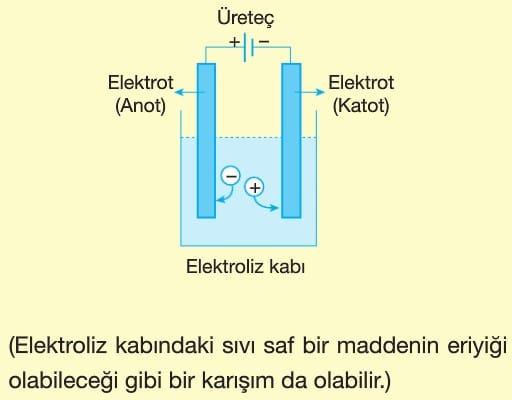
Elektrik enerjisi kullanılarak, kendiliğinden gerçekleşmeyen redoks tepkimelerinin gerçekleştirilmesi işlemine elektroliz denir.
Pillerde kimyasal enerji elektrik enerjisine dönüşürken, elektroliz işleminde elektrik enerjisi kimyasal enerjiye dönüşür.
Pillerde çözeltiler farklı kaplarda bulunurken, elektrolizde çözelti tek bir kabın içinde bulunabilir.
Pillerde elektrotlar farklı kaplarda bulunurken, elektrolizde elektrotlar aynı kabın içinde bulunabilir.
Elektrolizde elektrik akımı pil ya da akümülatör gibi üreteçlerden sağlanır.
Üretecin pozitif (+) kutbuna bağlanan elektrot anot, negatif (—) kutbuna bağlanan elektrot katot olur.
Elektroliz kabında da pillerde olduğu gibi anotta yükseltgenme, katotta indirgenme olur. Anyonlar anota giderek yükseltgenirken, katyonlar katota giderek indirgenir.
Karışımların Elektrolizi:
Elektroliz kabında asit, baz ve tuzdan gelen iyonların dışında sudan gelen H+ ve OH– iyonları da vardır.
Karışımdaki anyonları anota, katyonlar katota giderler.
Elektrolizde her zaman pasif olan önce toplanır.
Pozitif(+) yüklü iyonlarda elektron verme özelliği M, negatif (-) yüklü iyonlarda ise elektron verme özelliği fazla olan en pasiftir.
Elektron verme özelliği yükseltgenme gerilimleri ile doğru orantılıdır.
OH– ‘nin yükseltgenmesi ile O2(g) açığa çıkar.
Faraday Kanunları:
İndirgenen ve yükseltgenen madde miktarları devreden geçen yük miktarı ile doğru orantılıdır.
1 mol elektron geçen elektroliz devresinde 1 eşdeğer—gram madde toplanır.
1 mol elektron, 1 Faraday ya da 96500 coulomb yüke eşittir.
Pil sisteminde voltmetre yerine üreteç bağlanırsa dört farklı durum ortaya çıkabilir.
1. Üreteç, anot ve katotu değiştirmeyecek şekilde (aynı yönlü) bağlanırsa pil çalışmaya devam eder.
2. Üreteç, anot ve katotu değiştirecek şekilde (zıt yönlü) ve eşit gerilimde bağlanırsa pil çalışmaz.
3. Üreteç, zıt yönlü ve düşük gerilimde bağlanırsa pil çalışmaya devam eder ve pil potansiyeli azalır.
4. Üreteç, zıt yönlü ve yüksek gerilimde bağlanırsa pil şarj olmaya başlar ve anot ile katot yer değiştirir.
Elektrolizin Kullanım Alanları:
Metallerin saflaştırılması
Pillerin ve akümülatörlerin şarj edilmesi
Korozyonun (paslanmanın) etkilerinin azaltılması
Kuyumculukta (altın ve gümüş kaplama) elektroliz işlemi uygulanır.
Korozyonun önlenmesi için metalin yüzeyi boyanır ya da farklı bir metal kullanılarak katodik koruma yapılır.
Nikel kaplamada; nikelle kaplanacak madde katot, nikel ise anot olarak kullanılır. Nikel iyonları katota giderek indirgenir ve madde nikelle kaplanmış olur.
Krom kaplamada; krom anot, kaplanacak madde ise katot olarak kullanılır. Bu işlemde CrO3‘ün sulu çözeltisi de kullanılır.
Bakır kaplamada; bakır anot, kaplanacak madde ise katot olarak kullanılır. Endüstride bakırın saflaştırılması bu yöntemle yapılır.
Çözümlü Örnek Test Soruları: Elektroliz ve Kullanım Alanları
1. Aşağıdakilerden hangisi elektroliz için doğru bir tanımdır?
A) Elektrik enerjisinin kimyasal enerjiye dönüşmesi
B) Kimyasal enerjinin ısı enerjisine dönüşmesi
C) Kimyasal enerjinin elektrik enerjisine dönüşmesi
D) Isı enerjisinin mekanik enerjiye dönüşmesi
Çözüm:
Elektroliz, elektrik enerjisinin kimyasal enerjiye dönüşmesini sağlayan bir olaydır. Dışarıdan verilen elektrik enerjisi ile elektrotlarda kimyasal reaksiyonlar gerçekleşir.
Cevap: A
2. Aşağıdakilerden hangisi elektrolizin bir kullanım alanı değildir?
A) Metal kaplama
B) Saf metal eldesi
C) Akülerin şarj edilmesi
D) Tuzlu suyun buharlaştırılması
Çözüm:
Elektroliz, metal kaplama, saf metal eldesi ve çeşitli endüstriyel uygulamalarda kullanılır. Ancak tuzlu suyun buharlaştırılması bir fiziksel değişimdir ve elektroliz gerektirmez.
Cevap: D
3. Elektroliz işlemi sırasında aşağıdakilerden hangisi gerçekleşir?
A) Katotta yükseltgenme, anotta indirgenme olur.
B) Katotta indirgenme, anotta yükseltgenme olur.
C) Elektronlar çözelti içinde hareket eder.
D) Reaksiyonlar sadece çözeltilerde gerçekleşir.
Çözüm:
Elektrolizde katotta indirgenme, anotta ise yükseltgenme gerçekleşir. Yani, katotta pozitif iyonlar elektron alırken, anotta negatif iyonlar elektron kaybeder.
Cevap: B
4. Elektroliz yöntemiyle aşağıdaki metallerden hangisi saf halde elde edilebilir?
A) Bakır
B) Çinko
C) Alüminyum
D) Hepsi
Çözüm:
Elektroliz, birçok metalin saf halde elde edilmesini sağlar. Bakır, çinko ve alüminyum elektroliz yöntemiyle saflaştırılabilir.
Cevap: D
5. Elektroliz işlemiyle aşağıdaki maddelerden hangisi üretilebilir?
A) Oksijen ve hidrojen gazı
B) Karbondioksit gazı
C) Metan gazı
D) Kükürt dioksit gazı
Çözüm:
Su elektroliziyle oksijen ve hidrojen gazı elde edilir. Bu yöntem özellikle hidrojen enerjisi üretimi için kullanılır.
Cevap: A