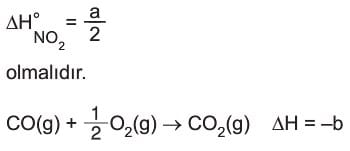Standart şartlarda (25°C, 1 atm) elementlerden başlayarak bileşiklerin oluşumu sırasında meydana gelen enerji değişimine standart oluşum entalpisi denir. Oluşum entalpileri Hf0 veya H0 ile gösterilir. Tepkimenin elementlerden başlamasının nedeni standart şartlarda elementlerin oluşma entalpilerinin sıfır kabul edilmesidir. Örneğin standart şartlarda suyun oluşum tepkimesinin entalpisi,
MOLAR OLUŞUM ISISI
Standart koşullarda bir mol bileşiğin elementlerinden oluşumu sırasında meydana gelen ısı değişimine molar oluşum ısısı veya molar oluşma entalpisi denir.
BİLGİ: Oluşma entalpisine bakılırken karbonun allotroplarından C(grafit) standart alınır. Örneğin elmasın yakılması sırasında çıkan ısı CO2 gazının molar oluşum ısısı değildir. Ayrıca oksijenin allotroplarından oksijen gazı (O2) standart kabul edilir. Molar oluşum entalpisinde oluşan ürünün katsayısının “1″ olmasına ve girenlerin element olmasına dikkat edilmelidir.
Tepkimeye girenler element olsa da üründen 2 mol NO2 gazı oluştuğu için a değeri NO2 nin molar oluşma entalpisi değildir. NO2 gazının molar oluşma entalpisi,
Bu tepkimenin entalpi değeri de CO2 gazının molar oluşma entalpisi değildir; çünkü girenlerde bileşik vardır. Bu tepkimenin entalpisine CO gazının molar yanma entalpisi denir.
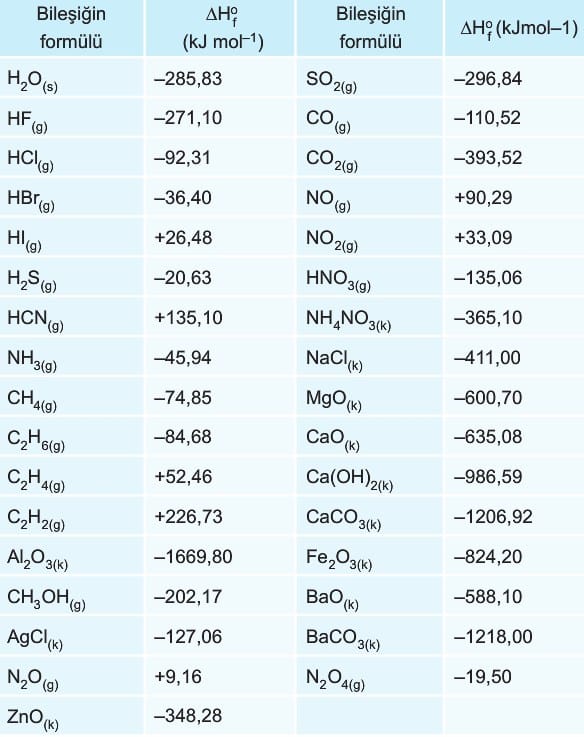
Aşağıdaki tabloda bazı maddelerin standart oluşum entalpileri verilmiştir.
TEPKİME ENTALPİLERİNİN HESAPLANMASI
Oluşma Entalpilerinden Tepkime Entalpisinin Hesaplanması
Tepkime entalpisini hesaplarken ürünlerin toplamı oluşma entalpilerinden girenlerin toplam oluşma entalpileri çıkartılır.
BİLGİ: Tepkime entalpilerinde kullanılan (-) veya (+) işaret tepkime ısının yönünü belirtmek içindir. Bir büyüklük göstergesi değildir. Eğer soruda ne kadar ısı çıkar veya ısı gerekir deniyorsa, yön belirttiği için bulunan değer pozitif işaretlidir.
Molar Tepkime Entalpisi
Herhangi bir tepkimede “molar” ifadesi kullanılmış ise bir mol maddenin tepkimeye girdiğini gösterir. Eğer tepkime yanma tepkimesi ise molar yanma, nötralleşme tepkimesi ise molar nötrleşme ısısı olarak ifade edilir.
1. Molar Yanma Entalpisi
1 mol maddenin yanması sırasında alınan ya da verilen ısıya molar yanma entalpisi denir. N2 yanması hariç tüm yanma tepkimeleri ekzotermiktir.
2. Molar Nötralleşme Isısı
1 mol asit veya bazın nötralleşmesi sırasında açığa çıkan ısı miktarına molar nötralleşme ısısı denir. Nötralleşme tepkimeleri ekzotermiktir.
Oluşum Entalpisi video 11. sınıf Hocalara Geldik